Uhlík
- 2551
- 517
- Alfréd Blaho
Čo je uhlík?
On uhlík Je to nemetalický chemický prvok, ktorého chemický symbol je C. Jeho názov je spôsobený uhlím, zeleninou alebo minerálom, kde jeho atómy definujú rôzne štruktúry. Tvorí širokú škálu organických a anorganických zlúčenín a tiež sa prezentuje v značnom počte alotropov.
Uhlík sa nachádza u všetkých živých bytostí; Všetky jej biomolekuly vďačia za svoju existenciu stabilite a sile väzieb C-C a ich vysokej tendencii zreťaziť. Je to prvok života a s atómami sú postavené ich telá.
Organické zlúčeniny, s ktorými sa biomateriály stavajú. Tieto je možné vidieť na prvý pohľad v dreve stromov; A tiež, keď na nich padne blesk a Rostiza. Zostávajúca inertná čierna pevná látka má tiež uhlík; Ale je to zeleninové uhlie.
Vlastnosti uhlíka
Fyzikálne alebo chemické vlastnosti nachádzajúce sa v tuhých látkach, mineráloch alebo uhlíkových materiáloch podliehajú mnohým premenným. Medzi nimi patrí: zloženie alebo stupeň nečistôt, hybridy atómov uhlíka, rozmanitosť štruktúr a morfológia alebo veľkosť pórov.
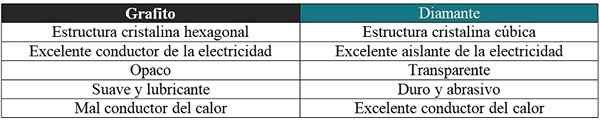
Keď opíše vlastnosti uhlíka, väčšina bibliografických textov alebo zdrojov je založená na grafite a diamantoch.
Pretože? Pretože sú najznámejšími alotropmi pre tento prvok a predstavujú tuhé látky alebo materiály s vysokou čistotou; To znamená, že sa prakticky nevyrábajú nič viac ako atómy uhlíka (hoci s rôznymi štruktúrami, ako bude vysvetlené v nasledujúcej časti).
Vlastnosti zeleninového a minerálneho uhlia sa líšia v ich pôvode alebo kompozíciách. Napríklad lignit (zlý uhlík) ako palivo Gatea v porovnaní s antracitou (bohatý na uhlík). A čo povedať o ostatných alotropoch: nanotrubice, fullerenos, grafén, grafos atď.
Chemicky však majú spoločný bod: oxidujú sa s nadbytkom kyslíka v CO2:
C + Ani2 => Co2
Teraz je rýchlosť alebo teplota, ktorú potrebujú na oxidáciu.
Grafit vs diamant
Tu sa uvedie aj stručný komentár týkajúci sa rôznych vlastností pre tieto dva alotropy:
 Tabuľka, v ktorej sa porovnávajú niektoré vlastnosti dvoch kryštalických množstiev uhlíka. Zdroj: Gabriel Bolívar.
Tabuľka, v ktorej sa porovnávajú niektoré vlastnosti dvoch kryštalických množstiev uhlíka. Zdroj: Gabriel Bolívar. Elektronická štruktúra a konfigurácia
Hybridizácia
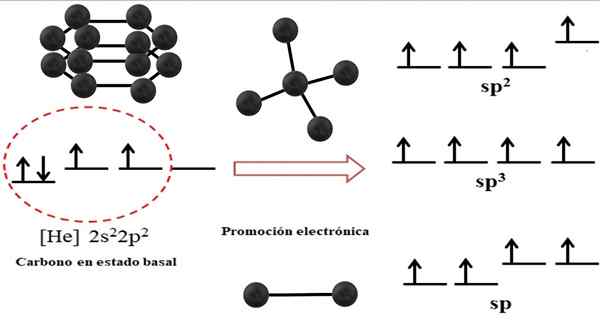 Vzťah medzi hybridnými orbitálmi a možnými štruktúrami uhlíka. Zdroj: Gabriel Bolívar.
Vzťah medzi hybridnými orbitálmi a možnými štruktúrami uhlíka. Zdroj: Gabriel Bolívar. Elektronická konfigurácia pre atóm uhlíka je 1S22s22 P2, tiež napísané ako [on] 2s22 P2 (horný obrázok). Toto znázornenie zodpovedá jeho bazálnemu stavu: atóm uhlíka izolovaný a suspendovaný v takom vákuu, ktorý nemôže interagovať s ostatnými.
Môže vám slúžiť: kryštalická štruktúraZhodnotilo sa, že jeden z jeho orbitálov 2p nemá elektróny, ktoré akceptuje elektrón orbitálu menšej energie elektronickou propagáciou; A tak atóm získava schopnosť vytvárať až štyri kovalentné väzby prostredníctvom svojich štyroch hybridných orbitálov SP3.
Všimnite si, že štyri orbitály SP3 Sú degenerované energiou (zarovnané na rovnakej úrovni). Orbitáli p Čisté sú energickejšie, a preto sú nad ostatnými hybridnými orbitálmi (napravo od obrázka).
Ak existujú tri hybridné orbitály, je to preto, že orbitálne zostávajú p bez hybridizácie; Preto sú to tri orbitály SP2. A keď sú dve z týchto hybridných orbitálov, dva orbitály p Sú k dispozícii na vytvorenie dvojitých alebo trojitých väzieb, čo je hybridizácia uhlíka F uhlíka.
Takéto elektronické aspekty sú nevyhnutné na pochopenie toho, prečo sa uhlík nachádza v alotropných neinportách.
Oxidácia
Pred pokračovaním v štruktúrach nie je iní spomenúť, že vzhľadom na elektronickú konfiguráciu Valencie 2S22 P2, Uhlík môže mať nasledujúce oxidačné čísla: +4, +2, 0, -2 a -4.
Pretože? Tieto čísla zodpovedajú predpokladu, že existuje iónová väzba tak, aby ste vytvorili ióny s príslušnými zaťaženie; to znamená, c4+, C2+, C0 (neutrálne), c2- a c4-.
Aby bol uhlík kladné oxidačné číslo, musí stratiť elektróny; A na to, že to musí byť nevyhnutne spojené s veľmi elektronegatívnymi atómami (napríklad kyslík).
Medzitým, aby mal uhlík negatívne oxidačné číslo, musí získať elektróny spojené s kovmi alebo menej elektronegatívnymi atómami ako on (napríklad vodík).
Prvý problém s oxidáciou, +4, znamená, že uhlík stratil všetky valenčné elektróny; Orbitály 2s a 2p sú prázdne. Ak orbitál 2p stratí svoje dva elektróny, uhlík bude mať číslo oxidácie +2; Ak vyhráte dva elektróny, budete mať -2; A ak vyhrá dva elektróny, ktoré dokončujú jeho oktet z Valencie, -4.
Príklady
Napríklad pre CO2 Číslo oxidácie uhlíka je +4 (pretože kyslík je viac elektronegatívny); Zatiaľ čo pre Cho4, je -4 (pretože vodík je menej elektronegatívny).
Môže vám slúžiť: hydrazín: štruktúra, vlastnosti, syntéza, použitieZa ch3OH, číslo oxidácie uhlíka je -2 (+1 pre H a -2 pre O); Zatiaľ čo pre HCOOH, je to +2 (skontrolujte, či súčet 0).
Pravdepodobne sú tiež pravdepodobné aj iné oxidačné stavy, ako napríklad -3 a +3, najmä pokiaľ ide o organické molekuly; Napríklad v metylových skupinách, -ch3.
Molekulárne geometrie
Na nadradenom obraze sa ukázal nielen hybridizácia orbitálov pre atóm uhlíka, ale aj výsledné molekulárne geometrie, keď je niekoľko atómov (čierne gule) spojené s centrálnym. Tento centrálny atóm na disponáciu špecifického geometrického prostredia vo vesmíre musí mať príslušnú chemickú hybridizáciu, ktorá je povolená.
Napríklad pre Tetrahedron má centrálny uhlík hybridizácia SP3; Pretože je to najstabilnejšie usporiadanie pre štyri hybridné SP3. V prípade karbónov SP2, Môžu tvoriť dvojité odkazy a zlikvidovať trigonálne ploché prostredie; A tak, tieto trojuholníky definujú perfektný šesťuholník. A pre hybridizáciu SP, uhlíky prijímajú lineárnu geometriu.
Geometrie pozorované v štruktúrach všetkých alotropov sú teda jednoducho riadené v Tetrahedre (SP3), šesťuholníky alebo pentagóny (SP2) a čiary (SP).
Tetrahedra definuje 3D štruktúru, zatiaľ čo šesťuholníky, pentagóny a čiary, 3D alebo 2D štruktúry; Posledne menované sa stanú lietadlami alebo plachtami podobnými stenám včelieho plást:
 Stena s hexagonálnymi návrhmi včelieho voštiny v analógii s lietadlami zloženými z uhlíkov SP2. Zdroj: Pixabay.
Stena s hexagonálnymi návrhmi včelieho voštiny v analógii s lietadlami zloženými z uhlíkov SP2. Zdroj: Pixabay. A ak zložíme túto šesťuholníkovú stenu (pentagonálna alebo zmiešaná), dostaneme trubicu (nanotrubice) alebo guľu (fullerene) alebo inú postavu. Interakcie medzi týmito číslami vedú k rôznym morfológiám.
Amorfné alebo kryštalické tuhé látky
Ich tuhé látky môžu opúšťať geometrie, hybridizácie alebo morfológie možných uhlíkov. A medzi týmito dvoma klasifikáciami sú ich alotropy distribuované.
Amorfný uhlík je jednoducho ten, ktorý predstavuje ľubovoľnú zmes tetraedry, šesťuholníkov alebo línií, ktorá nedokáže vytvoriť štrukturálny vzor; To je prípad uhlia, zeleniny alebo aktivovaného uhlia, koksu, sadzí atď.
Zatiaľ čo kryštalický uhlík pozostáva zo štrukturálnych vzorov tvorených niektorou z chovaných geometrií; Napríklad Diamond (trojrozmerná sieť Tetrahedra) a grafit (naskladané hexagonálne listy).
Môže vám slúžiť: dusičnan sodný (Nano3): štruktúra, vlastnosti, použitia, rizikáKde je uhlík?
Okrem toho, že je chemickým prvkom spoločným vo všetkých formách života, je uhlík v prírode prítomný v troch kryštalických formách: diamant, grafit a vodiaci.
Existuje tiež niekoľko amorfných uhoľných minerálnych foriem (antracit, lignit, nemý, rašelina), tekuté formy (odrody ropy) a sóda (zemný plyn).
Žiadosti
Rovnako ako vlastnosti a štruktúra, aj použitia alebo aplikácie sú v súlade s alotrogami alebo mineralogickými formami uhlíka. Okrem niektorých vysoko známych bodov však možno spomenúť určité všeobecnosti. Také sú:
-Uhlík sa pri získavaní čistých kovov používa už dlho ako činidlo redukčné minerály; Napríklad železo, kremík a fosfor,.
-Je to základný kameň života a organická chémia a biochémia sú štúdie tejto reflexie.
-Bolo to tiež fosílne palivo, ktoré umožnilo prvým strojom ísť na ich prevodový stupeň. Rovnakým spôsobom sa od neho získal uhlíkový plyn pre staré osvetľovacie systémy. Uhlie bolo synonymom svetla, tepla a energie.
-Zmiešané ako prísadka so železom v rôznych rozmeroch umožnilo vynález a zlepšenie ocelí.
-Jeho čierna farba sa odohrala v umení, najmä grafite a všetky spisy vytvorené s ich ťahmi.
Riziká a preventívne opatrenia
Uhlík a jeho pevné látky nepredstavujú žiadne zdravotné riziko. Kto sa obával o uhoľnú tašku? Predávajú ich na veľa v sálach na niektorých trhoch, a pokiaľ nie je blízko ohňa, ich čierne bloky nebudú horieť.
Koks na druhej strane môže predstavovať riziko, ak je jeho obsah síry vysoký. Pri spaľovaní uvoľní plyny síry, ktoré okrem toxického prispievajú k kyslému dažďu. A hoci CO2 V malom množstve nás nemôže dusiť, má obrovský vplyv na životné prostredie ako skleníkový plyn.
Z tohto hľadiska je uhlík „dlhým“ nebezpečenstvom, pretože jeho spaľovanie mení podnebie našej planéty.
A vo fyzickejšom zmysle sú tuhé látky alebo uhlíkovo materiály, ak sa striekali, ľahko prepravené vzduchovými prúdmi; A preto sa zavádzajú priamo do pľúc, čo ich môže nezvratne poškodiť.
Zvyšok je veľmi bežné konzumovať „uhlie“, keď sa nejaké jedlo varí.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.

