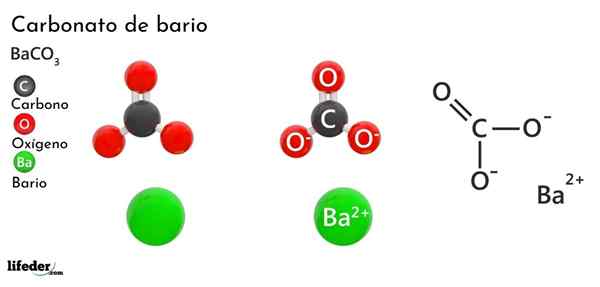
Uhličitan bária (Baco3)
- 3887
- 270
- JUDr. Rudolf Čapkovič
Čo je uhličitan bárnat?
On uhličitan bárnat Je to anorganická soľ kovového bario, predposledný prvok skupiny 2 periodickej tabuľky a ktorá patrí do alkalinoterróznych kovov. Jeho chemický vzorec je bacchus3 A je k dispozícii na trhu vo forme bieleho kryštalického prachu.
Ako sa získa? Kovové bária sa nachádza v mineráloch, ako je barite (Baso4) a belčle (bacchus3). Whiterit je spojený s inými minerálmi, ktoré zostávajú úrovňou čistoty pre svoje biele kryštály výmenou za sfarbenie.
Na generovanie bacchus3 syntetického použitia je potrebné odstrániť nečistoty belérite, ako je naznačené nasledujúcimi reakciami:
Bacchus3(S, nečisté) + 2nh4Cl (s) + q (teplo) => bacl2(aq) + 2nh3g) + h2Alebo (l) + co2g)
Bacl2(aq) + (nh4)2Co3(s) => bacchus3(s) + 2nh4Cl (aq)
Barita je však hlavným zdrojom bária, a preto z toho začínajú priemyselné výroby zlúčenín bária. Tento minerálny syntetizuje sulfid báriu (BAS), produkt, z ktorého syntéza iných zlúčenín a bacchus tečie3:
Bas (s) + na2Co3(s) => bacchus3(s) + na2H.H)
Bas (s) + co2g) + h2Alebo (l) => bacchus3(s) + (NH4)2S (aq)
Bario uhličitan Vlastnosti
 Uhličitanové prach
Uhličitanové prach Je to prašné, biele a kryštalické. Je to toaleta, rozpad a jeho molekulová hmotnosť je 197,89 g/mol. Má hustotu 4,43 g/ml a neexistujúci tlak pary.
Má rýchlosť lomu 1 529, 1 676 a 1 677. Witherita emituje svetlo, keď absorbuje ultrafialové žiarenie: od jasne bieleho svetla s modrými tónmi až po žlté svetlo.
Je vysoko nerozpustný vo vode (0,02 g/l) a v etanole. V roztokoch kyseliny HCL tvorí rozpustná soľ chloridu bario (BACL2), čo vysvetľuje jeho rozpustnosť v týchto kyslých médiách. V prípade kyseliny sírovej vyzráža, ako nerozpustná soľná báza4.
Môže vám slúžiť: oxid beryl (včela)Bacchus3(s) + 2HCl (aq) => bacl2(aq) + co2g) + h2Alebo (l)
Bacchus3(s) + h2SW4(aq) => baso4(s) + co2g) + h2Alebo (l)
Pretože je to iónová tuhá látka, je tiež nerozpustný v apolárnych rozpúšťadlách. Uhličitan bárnat sa topí pri 811 ° C; Ak sa teplota zvyšuje okolo 1380-1400 ° C, slaná kvapalina trpí chemickým rozkladom namiesto varenia. Tento proces sa vyskytuje pre všetky kovové uhličitany: MCO3(s) => MO (s) + co2g).
Tepelný rozklad
Bacchus3(s) => bao (s) + co2g)
Ak sú iónové tuhé látky charakterizované tým, že sú veľmi stabilné, prečo sa uhličitany rozkladajú? Mení kov teplotu, pri ktorej sa tuhá látka rozpadá? Ióny, ktoré tvoria uhličitan bárničko, sú BA2+ a co32-, obidve objemné (to znamená s veľkými iónovými rádiámi). CO32- Je zodpovedný za rozklad:
Co32-(s) => o2-g) + Co2g)
Oxidový ión (alebo2-) Kov je spojený s kovovým, kovovým oxidom. MO generuje novú iónovú štruktúru, v ktorej je spravidla podobná veľkosť jeho iónov, tým stabilnejšia je výsledná štruktúra (entalpia siete). Opak sa stane, ak ióny m+ I2- Majú veľmi nerovnaké iónové rádiá.
Ak je entalpia siete veľká, je energeticky uprednostňovaná reakcia rozkladu, ktorá si vyžaduje nižšie teploty zahrievania (nižšie body varu) menšie).
Na druhej strane, ak má MO malú sieťovú entalpiu (ako v prípade Bao, kde BA2+ Má väčšie iónové rádio ako alebo2-) Rozklad je menej obľúbený a vyžaduje vyššie teploty (1380-1400 ° C). V prípadoch MGCO3, Zlodej3 a SRCO3, Rozkladá sa pri nižších teplotách.
Môže vám slúžiť: horčík: história, štruktúra, vlastnosti, reakcie, použitieChemická štruktúra
Anión Co32- Má dvojitú väzbu rezonujúcu medzi tromi atómami kyslíka, dva z nich sú negatívne nabité, aby prilákali katión BA2+.
Zatiaľ čo oba ióny sa môžu považovať za načítané gule, CO32- Má plochú trigonálnu geometriu (plochý trojuholník nakreslený tromi atómami kyslíka), ktorá je pravdepodobne negatívnou „podložkou“ pre BA2+.
Tieto ióny interagujú elektrostaticky za vzniku kryštalického usporiadania ortorrhrombického typu, čo je prevažne iónové väzby.
V takom prípade, prečo nie je Bacchus rozpustný3 Vo vode? Vysvetlenie je jednoducho založené na skutočnosti, že ióny sú lepšie stabilizované v kryštalickej sieti, ako hydratované sférickými molekulárnymi vrstvami vody.
Z iného uhla molekuly vody sťažujú prekonanie silných elektrostatických atrakcií medzi týmito dvoma iónmi. V týchto kryštalických sieťach môžu ubytovať nečistoty, ktoré dávajú farbu svojim bielym kryštálom.
Žiadosti
Na prvý pohľad časť Bacchus3 Nemusí sľubovať žiadne praktické uplatňovanie v každodennom živote, ale ak existuje kryštál beloštálového minerálu, bieleho mlieka, začína mať zmysel, prečo jeho ekonomický dopyt.
Sa používa na výrobu bárnatého skla alebo ako prídavná látka na ich posilnenie. Používa sa tiež pri výrobe optického skla.
Vzhľadom na svoju veľkú sieť a entalpiu nespoľahlivosti sa používa pri výrobe rôznych typov zliatiny, gumberov, ventilov, podláh podlahy, maľieb, keramiky, maziva, plastov, tukov a cementov.
Používa sa tiež ako jed pre myši. Stručne povedané, táto soľ sa používa na výrobu iných zlúčenín bária, a teda slúži ako materiály elektronických zariadení.
Môže vám slúžiť: kyselina sulfanylová: Štruktúra, vlastnosti, syntéza, použitieBacchus3 Môže sa syntetizovať ako nanočastice a exprimuje veľmi malé mierky nové zaujímavé vlastnosti belčiny. Tieto nanočastice sa používajú na prenikanie kovových povrchov, konkrétne chemických katalyzátorov.
Zistilo sa, že zlepšuje oxidačné katalyzátory a to nejako uprednostňuje migráciu molekúl kyslíka svojou povrchom.
Považujú sa za náradie na urýchlenie procesov, do ktorých je kyslík začlenený. A nakoniec sa používajú na syntézu supramolekulárnych materiálov.
Riziká
Bacchus3 Je to jedovaté v dôsledku požitia, ktoré spôsobuje nekonečno nepríjemných symptómov, ktoré vedú k smrti v dôsledku zlyhania dýchacích ciest alebo zástavy srdca; Z tohto dôvodu sa neodporúča prepravovať vedľa jedlého tovaru.
Vytvára začervenanie očí a pokožky, okrem kašľa a bolesti v krku. Je to toxická zlúčenina, aj keď sa ľahko manipuluje s holými rukami, ak sa jeho požitiu za každú cenu vyhýba.
Nie je to horľavé, ale pri vysokých teplotách sa rozkladá a vytvára bao a co2, Toxické a oxidačné výrobky, ktoré môžu spaľovať iné materiály.
V organizme sa barium ukladá v kostiach a iných tkanivách a nahradí vápnik v mnohých fyziologických procesoch. Tiež blokuje kanály, kde k ióny cestujú+, bránenie jeho difúzii cez bunkové membrány.
Odkazy
- Publikácia. (2018). Uhličitan bárnat. Získané 24. marca 2018 z Pubchem: Pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2017). Uhličitan bárnat. Získané 24. marca 2018 z Wikipédie: In.Wikipedia.orgán
- Chemická kniha. (2017). Uhličitan bárnat. Získané 24. marca 2018 z Chemicalbook: Chemicalbook.com
- Robbins Manuel a. (1983).Robbins Zberateľská kniha fluorescenčných minerálov. Fluorescenčné minerály Popis, P-117.
- Triasť a Atkins. (2008). Anorganická chémia. V Štruktúra jednoduchých tuhých látok (Štvrté vydanie., p. 99-102). MC Graw Hill.