Tvorba karbocation, charakteristiky, typy, stabilita
- 3943
- 234
- MUDr. Miloslav Habšuda
A karbocation, Ako už názov napovedá, je to organický ión, ktorý má pozitívne zaťažený atóm. Zvyčajne je sprostredkovateľom organických reakcií, to znamená, že pochádza ako nevyhnutné kroky príslušných molekulárnych mechanizmov.
Historicky sa vyskytli konfliktné body v kompresii toho, čo je karbocation. Je to preto, že existujú symfíny reaktívnych molekúl, ktoré z nejakého dôvodu získavajú pozitívne zaťaženie v jednom z ich uhlíkov. Klasická karbocation, takpovediac, je taká, ktorá môže byť reprezentovaná všeobecným vzorcom obrázka nižšie.
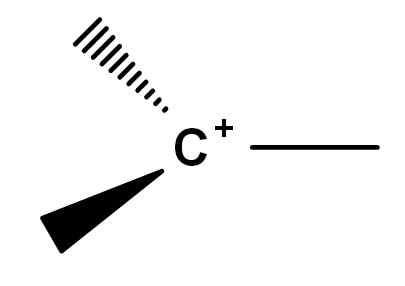 Všeobecný vzorec karbocation. Zdroj: Gabriel Bolívar.
Všeobecný vzorec karbocation. Zdroj: Gabriel Bolívar. Všimnite si, ako sa kladné zaťaženie nachádza presne na atóme uhlíka a tiež mu chýba odkaz. Karbocation je preto zlé elektróny, čo je príčinou jeho vysokej reaktivity.
Predpokladajme metán, cho4. Keby uhlík stratil jeden zo svojich atómov vodíka, odstránili by sme jednu zo štyroch väzieb C-H. Potom vznikla metylzajká3+, ktoré by sme mohli reprezentovať iba umiestnením atómov vodíka na koncoch pruhov hornej receptúry. CH3+ Je to najjednoduchšie zo všetkých karbocacií.
[TOC]
Výcvik
Ako sa tvoria karbocetácie? Odpoveď sa nachádza v reakčných mechanizmoch. Prevažná väčšina však spoločne podieľa na jednom z nasledujúcich dvoch aspektov:
-Heterolytické prasknutie
-Pridanie elektrónov π do elektrofilu
Heterolytické prasknutie
V heterolitickom prasknutí väzby C-g, G je akýkoľvek atóm alebo skupina, je rozbité nerovnomerným spôsobom: elektróny väzby sú ponechané G, zatiaľ čo atóm uhlíka získa kladné zaťaženie. Napríklad:
Môže vám slúžiť: arzén: História, štruktúra, vlastnosti, použitia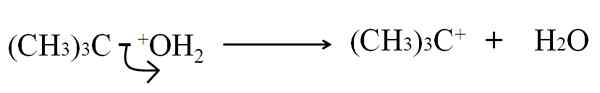 Heterolytické prasknutie v dehydratácii tertbutanolu. Zdroj: Gabriel Bolívar.
Heterolytické prasknutie v dehydratácii tertbutanolu. Zdroj: Gabriel Bolívar. Teraz je možné túto prestávku poskytnúť pre niekoľko metód, ktoré zase zmenia mechanizmus a reakciu.
Pridanie elektrónov π do elektrofilu
Ďalším procesom, ktorým sa tvorí karbocation, je veľmi častý v aromatických alkénoch a zlúčeninách, je útočením na elektróny dvojitého väzby na elektrofilu. Najbežnejšími prípadmi sú hydrogenácia alkénov pôsobením kyseliny:
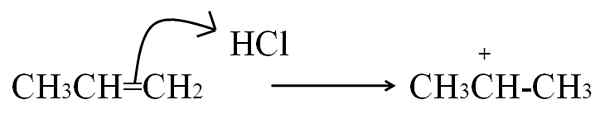 Reakcia HCl s propeno za vzniku karbocation ako sprostredkovateľa. Zdroj: Gabriel Bolívar.
Reakcia HCl s propeno za vzniku karbocation ako sprostredkovateľa. Zdroj: Gabriel Bolívar. Táto rovnica zodpovedá tvorbe karbocation, ktorá Je to a sprostredkovateľ, Nie produkt. Dvojité väzbové elektróny napadajú vodík HCl, elektrofil. Vodík sa pridáva do uhlíka napravo od dvojitého väzby, takže sa vytvorí skupina -ch3, Zatiaľ čo uhlík vľavo získava pozitívne zaťaženie.
Charakteristika
Hybridizácia
Všeobecný vzorec prezentovaný na začiatku odhaľuje trigonálnu plochú geometriu okolo atómu uhlíka. Je to kvôli hybridizácii, ktorú utrpeli atómové orbitály uhlíka, aby sa stali hybridnými orbitálmi SP2, ktoré sú oddelené pod uhlom 120 °. Aj keď to nie je zastúpené, karbocation má orbitál p Čisté a prázdne, schopné prijímať elektróny.
Kyslosť
Karbocation je kyslý druh, buď podľa definície Brönsted alebo Lewis. Ich kladné elektróny alebo atómy vodíka, ktoré sú uvedené. Z tohto dôvodu nemožno tvoriť karbocations vo veľmi základných médiách, pretože by okamžite reagovali na pôvodné výrobky.
Stabilita
Hybridizácia SP2 z karbocation je zraniteľná voči útokom bohatých druhov v elektronoch. Táto funkcia je ďalej zdôrazňovaná jej veľkou kyslosťou. V dôsledku toho je karbocation veľmi reaktívny druh, ktorý sa ťažko formuje a čoskoro (vo veci nanosekundov) reaguje, aby vznietil skutočný produkt chemickej reakcie.
Môže vám slúžiť: Kyselina sulfámová: Štruktúra, vlastnosti, syntéza, použitieTypy karbocations
Existuje niekoľko typov karbocacií. Tieto možno však klasifikovať takto:
-Primárny
-Druhoradý
-Terciárny
-Arilos
-Vinyl a alilic
Primárny
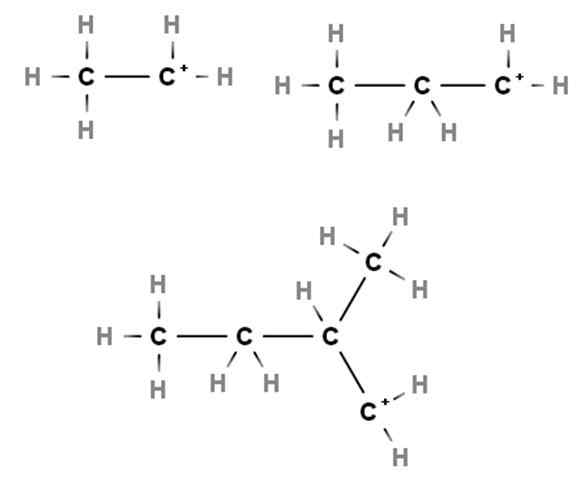 Primárne karboce. Zdroj: Gabriel Bolívar cez Molview.
Primárne karboce. Zdroj: Gabriel Bolívar cez Molview. Príchody ukazujú príklady primárnych karbocacií. Nazývajú sa to preto, že pozitívne zaťaženie spočíva v primárnom uhlíku, 1., takže je spojené iba s atómom uhlíka. Etano, ch3Chvály3, Keď H stratí ktorýkoľvek zo svojich cieľov, karbocation Cho3Chvály2+ ani +Chvály2Chvály3.
Druhoradý
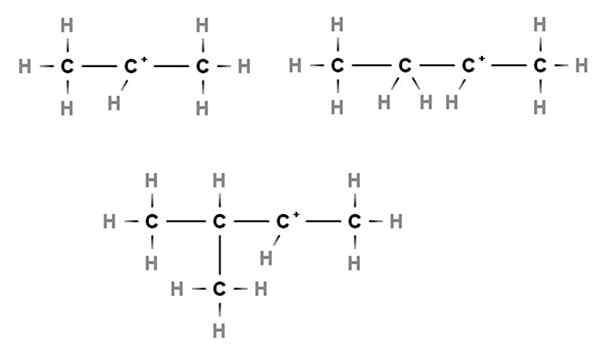 Sekundárne karbocations. Zdroj: Gabriel Bolívar cez Molview.
Sekundárne karbocations. Zdroj: Gabriel Bolívar cez Molview. Pri sekundárnych karbocations je pozitívne zaťaženie umiestnené v sekundárnom uhlíku, 2., ktorý je spojený s dvoma atómami uhlíka. Napríklad, ak propán, Cho3Chvály2Chvály3, Zoberieme H Centrálneho uhlíka, budeme mať karbocation Cho3Chvály2+Chvály3.
Terciárny
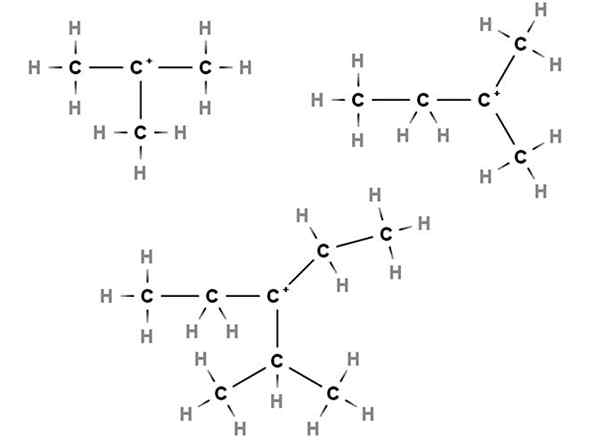 Terciárne karbocations. Zdroj: Gabriel Bolívar cez Molview.
Terciárne karbocations. Zdroj: Gabriel Bolívar cez Molview. V terciárnych karbocaciách je kladné zaťaženie umiestnené v terciárnom uhlíku, 3., spojenom s tromi atómami uhlíka. Všimnite si, že na rozdiel od prvých dvoch typov karbocacií nemajú atómy vodíka.
Máme teda metylpropán alebo izobután, CH (Vyberte3)3, Čo stratou vodíka, centrálny uhlík tvorí karbocation +C (ch3)3.
Aromatický
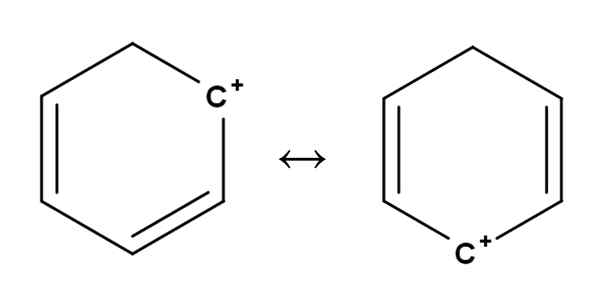 Benzénový karbocat. Zdroj: Gabriel Bolívar.
Benzénový karbocat. Zdroj: Gabriel Bolívar. Aromatické alebo aromatické karbocations sú pravdepodobne najzvláštnejšie zo všetkých. Váš výcvik je veľmi podobný výcviku opísaným pre alkény v prvej časti.
V nich je kladné zaťaženie v zásade umiestnené v jednom z uhlíkov aromatického kruhu, ako je benzén. Pozitívne zaťaženie však nie je pevné, ale je rozptýlené v iných kruhových pozíciách rezonanciou.
Môže vám slúžiť: Ribulosa-1,5-bifosfát (Rubp): Charakteristiky, karbolixáciaTakto pozitívne zaťaženie, ako je uvedené vyššie, prechádza z jedného uhlíka na druhý vo vnútri benzénového kruhu. Táto charakteristika dáva tejto karbokokácii veľkú stabilitu proti iným typom karbocations.
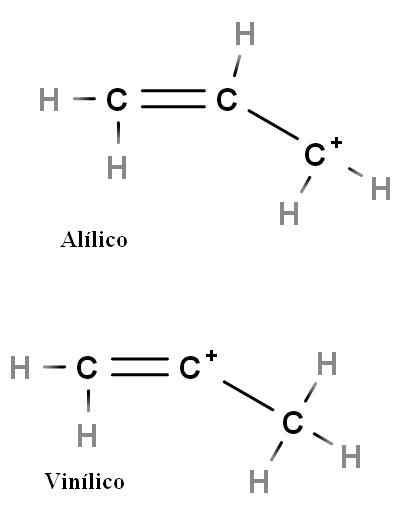
Alyl a vinyl
 Alyl a vinylové karbocation. Zdroj: Gabriel Bolívar.
Alyl a vinylové karbocation. Zdroj: Gabriel Bolívar. Ďalšími špeciálnymi typmi karbocacií sú alilic a vinyl. Rozdiel medzi nimi (vyššie) je poloha kladného náboja súvisiace s dvojitým dlhopisom.
Pri vinylovej karbóne sa kladné zaťaženie nachádza v jednom z uhlíkov s dvojitým väzbám; Zatiaľ čo pri alyickom karbocation sa kladné zaťaženie nachádza v uhlíku po dvojitej väzbe. Stačí nahradiť vodíny za iné skupiny a budeme mať obrovskú rodinu alyických a vinylových karbocations.
Relatívna stabilita
Vedieť, ktoré sú hlavné typy karbocacií, je možné ich objednať na základe ich relatívnej stability:
Vinyl < Primario < Secundario < Alílico < Terciario < Aromático
Teraz môžu existovať alické karbocations, ktoré sú stabilnejšie ako špecifický terciárny terciárny. Všetko bude závisieť od ich substituentov.
Prečo táto stabilita? Na schopnosť molekuly rozptýliť sa alebo znížiť kladné zaťaženie karbocation. Na tento účel potrebujete úzke atómy, ktoré poskytujú časť svojej elektronickej hustoty karbokácie hyperconjugáciou. Medzitým sa to v alumických a aromatických karbocations to dosahuje rezonanciou.
V prípade vinylovej karbokácie sa kladné zaťaženie nachádza na uhlíku, ktorý už bol SP2, Vďaka tomu je veľmi nestabilné.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Karbocation. Zdroj: In.Wikipedia.orgán
- James Ashenhurst. (20. februára 2020). 3 faktory, ktoré stabilizujú karbocations. Získané z: Masterorganicchemistry.com
- Clark Jim. (2000). Karboce (alebo ióny uhlíka). Získané z: Chemguide.co.Uk
- DR. Kennepohl, profesor. Siež. Farmár a t. Soderberg. (10. augusta 2020). Karbocačná štruktúra a stabilita. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Koncept, vlastnosti a príklady environmentálnych etických kódov
- 4 stanice roka v Mexiku a jeho vlastnosti »

