História Boro, vlastnosti, štruktúra, použitie

- 4982
- 1376
- Alan Milota
On bór Je to nemetalický prvok, ktorý vedie skupinu 13 periodickej tabuľky a je znázornený chemickým symbolom B. Jeho atómové číslo je 5 a je jediným nemetalickým prvkom v jeho skupine; Aj keď to niektoré chemikálie považujú za metaloid.
Je prezentovaný ako čierny hnedý prášok a je v pomere 10 ppm vo vzťahu k zemskej kôre. Preto to nie je jeden z najhojnejších prvkov.
 Vzorka boro s čistotou okolo 99%. Zdroj: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Vzorka boro s čistotou okolo 99%. Zdroj: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Je súčasťou niekoľkých minerálov, ako je Borax alebo sodný boritan, čo je najbežnejší bórový minerál. Existuje tiež Kurnite, iná forma vrtule sodného; Colenete alebo vápnikový boritan; a ulexi, sodný a vápnikový bora.
Boratos sa extrahujú v Spojených štátoch, Tibete, Číne a Čile so svetovou produkciou približne dvoch miliónov ton ročne.
Tento prvok má trinásť izotopov, ktoré sú najhojnejšie jedenásťB, ktorý predstavuje 80,1% bóru a 10B, ktorý tvorí zvyšných 19,9%.
Bór je nevyhnutnou stopou pre rastliny, zasahuje do syntézy niektorých životne dôležitých rastlinných proteínov a prispieva k absorpcii vody. U cicavcov sa zdá byť potrebné pre zdravie kostí.
Hoci bóru objavil v roku 1808 anglický chemik Sir Humphry Davy a francúzski chemici Jacques Thérnard a Joseph Gay-Lussac, od začiatku našej éry v Číne sa použil borax v rozpracovaní hrnčiarstva skál.
Bór a jeho zlúčeniny majú veľa použití a aplikácií, od ich používania pri ochrane potravín, najmä margarínu a rýb, až do použitia pri liečbe rakovinových nádorov mozgu, močového mechúra, prostaty a iných orgánov a iných orgánov a iných orgánov.
Bór nie je príliš rozpustný vo vode, ale jej zlúčeniny sú. Môže to byť koncentračný mechanizmus bóru, ako aj zdroj otravy s prvkom.
[TOC]
História
Pozadie
Pretože vzdialené časy človek používal bóru zlúčeniny v rôznych činnostiach. El Borax, minerál známy ako Tincal, sa použil v Číne v 300 dňoch.C. v rozpracovaní smaltovanej keramiky.
Perzský alchymista (865-925) uviedol prvú zmienku o zlúčeninách Boro. Razes klasifikoval minerály do šiestich tried, z ktorých jednou boli borocy, ktoré zahŕňali Bór.
Agricola, okolo roku 1600, uviedla použitie boraxu ako toku v metalurgii. V roku 1777 bola uznaná prítomnosť kyseliny boritej v prúde horúcich prameňov v blízkosti Florencie.
Objav prvku
Humphry Davy, cez elektrolýzu roztoku boraxu, pozoroval akumuláciu čiernej zrazeniny v jednej z elektród. Tiež zahrial oxid bóru (b2Ani3) S draslíkom, ktorý produkuje čierny hnedý prášok, ktorý bol známym formou bóru.
Gay-Lussac a Thénard znížili kyselinu boru pri vysokých teplotách v prítomnosti železa, aby sa vytvoril bór. Ukázali tiež spätný proces, to znamená, že kyselina boritá je produktom oxidácie bóru.
Identifikácia a izolácia
Jöns Jakob Berzelius (1827) dosiahol identifikáciu Boro ako nového prvku. V roku 1892 sa francúzsky chemik Henri Moissan podarilo vyrobiť Bór s 98% čistotou. Aj keď sa zdôrazňuje, že Bór bol vyrobený čisto americkým chemikom Ezekielom Weintraubom v roku 1909.
Vlastnosti
Fyzický popis
Kryštalický pevný alebo čierny hnedý amorfný prášok.
Môže vám slúžiť: peroxidy: vlastnosti, nomenklatúra, použitia, príkladyMolárna hmota
10,821 g/mol.
Bod topenia
2076 ° C.
Bod varu
3927 ° C.
Hustota
-Kvapalina: 2,08 g/cm3.
-Kryštalické a amorfné pri 20 ° C: 2,34 g/cm3.
Fúzne teplo
50,2 kJ/mol.
Odparovanie
508 kJ/mol.
Molárna kalikára
jedenásť.087 J/(mol · k)
Ionizačná energia
-Prvá úroveň: 800.6 kJ/mol.
-Druhá úroveň: 2.427 kj/mol.
-Tretia úroveň: 3.659,7 kJ/mol.
Elektronegativita
2.04 v Pauling Scale.
Atómové rádio
210 hod. (Empirické).
Atómový objem
4,16 cm3/mol.
Tepelná vodivosť
27,4 w/m.Klimatizovať
Elektrický odpor
~ 106 Ω.M (pri 20 ° C).
Vysoké teploty bór je dobrý elektrický vodič, ale pri teplote okolia sa stáva takmer izolátorom.
Tvrdosť
~ 9,5 na stupnici Mohs.
Reaktivita
Bór nie je ovplyvnený kyselinou chlorovodíkovou pri teplote varu. Je však prevedená kyselinou horúcou dusičnou na kyselinu boru (H3Bož3). Boro sa chemicky správa ako net -metal.
Reaguje so všetkými halogénmi, čím sa dá Trihaluros, vysoko reaktívny. Majú všeobecný vzorec BX3, Kde x predstavuje halogén.
Kombinuje sa s niekoľkými prvkami, aby vznikol Boruros. Niektoré z nich patria medzi látky väčšej tvrdosti; Napríklad bór nitrid (BN). Bór je kombinovaný s kyslíkom, aby sa vytvoril trikxid bóru.
Elektronická štruktúra a konfigurácia bóru
Odkazy a štrukturálne jednotky v Bóre
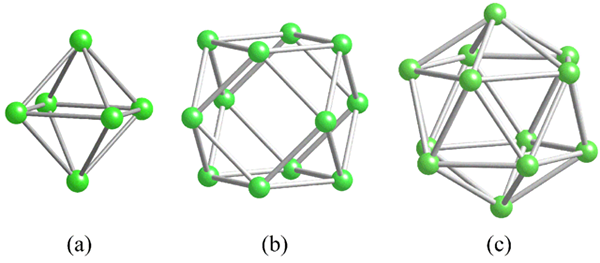 Geometrie bežných štrukturálnych jednotiek pre bór. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Geometrie bežných štrukturálnych jednotiek pre bór. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Pred riešením bórových štruktúr (kryštalických alebo amorfných) je nevyhnutné mať na pamäti, ako môžu byť ich atómy prepojené. Spojenie B-B je v kovalentnej podstate; Nielen to, ale aj preto, že atómy Boro majú elektronický nedostatok, pokúsia sa ho dodať svojím odkazom tak či onak.
V bórii je špeciálny typ kovalentnej väzby: z troch centier a dvoch elektrónov, 3C2E. Tu tri atómy bóru zdieľajú dva elektróny a definujú trojuholník, jednu z mnohých tvárí nachádzajúcich sa v ich štrukturálnych polyhedroch (vynikajúci obraz).
Zľava doprava máme: Octaedro (a, b6), Cuboctaedro (B, B12) A Isocasedro (C, B12 tiež). Všetky tieto jednotky zdieľajú funkciu: sú chudobné v elektronoch. Preto musia medzi sebou kovalentne prepojiť; A výsledkom je prekvapujúca strana prepojenia.
V každom trojuholníku týchto polyhedros je prítomný odkaz 3C2E. V opačnom prípade sa nedalo vysvetliť, ako bór, schopný vytvoriť iba tri kovalentné väzby podľa teórie Link Valencia, môže mať v týchto polyhedrálnych jednotkách až päť odkazov.
Bórové štruktúry potom pozostávajú z usporiadania a opakovania týchto jednotiek, ktoré nakoniec definujú kryštál (alebo amorfnú pevnú látku).
Boro a-romboédrico
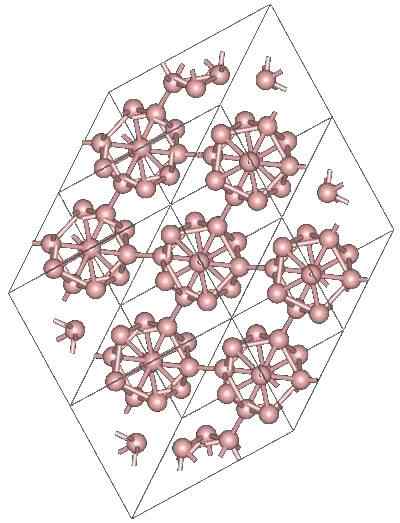 Kryštalická štruktúra a-romboédrico bóru alotropického. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Kryštalická štruktúra a-romboédrico bóru alotropického. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Môžu existovať ďalšie polyhedrálne jednotky Boro, ako aj zlúčenina iba dvoma atómami, b2; „Čiara“, ktorá musí súvisieť s ostatnými atómami po jeho vysokom elektronickom nedostatku.
Icosaedro je zďaleka preferovanou jednotou bóru; Ten, ktorý sa cíti lepšie. Napríklad na hornom obrázku sa oceňuje, ako tieto jednotky B12 Intertwine definujú rhombohedrálny kryštál bóru-a.
Keby sa jeden z týchto iCosaedros chcel izolovať, bola by to zložitá úloha, pretože ich elektronický nedostatok ich núti definovať kryštál, kde každý z nich poskytuje elektróny, ktoré ostatní susedia potrebujú.
Β-romboédrico bór
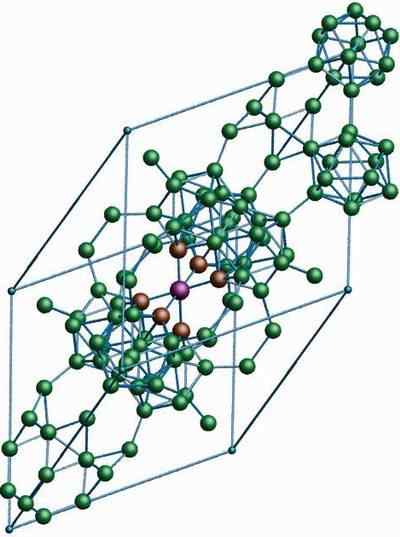 Kryštalická štruktúra p-romboédrico bóru alotropického. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Kryštalická štruktúra p-romboédrico bóru alotropického. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] P-romboédrico bór alotropický, ako už názov naznačuje, má kryštály rhomboédiky, ako aj bór-a; Líši sa však vo svojich štrukturálnych jednotkách. Vyzerá to ako mimozemská loď vyrobená z bórových atómov.
Môže vám slúžiť: hydroxid lítium (LIOH)Ak môžete starostlivo vidieť ikosedrické jednotky diskrétnym a zlúčeným spôsobom (v strede). Existujú aj jednotky B10 a osamelé atómy bóru, ktoré pôsobia ako most pre vyššie uvedené jednotky. Zo všetkého je to najstabilnejší bór.
Boro-y gema
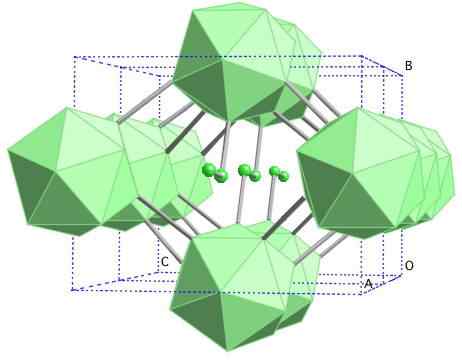 Kryštalická štruktúra bóru-y. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Kryštalická štruktúra bóru-y. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] V tomto bóre sú jednotky B koordinované2 a b12. B2 predstavuje toľko elektronického nedostatku, že v skutočnosti odstránia elektróny z B12 A preto existuje iónový charakter v tejto pevnej látke. To znamená, že nielenže sú kovalentne zjednotení, ale existuje aj typovej elektrostatickej príťažlivosti [b2-] [B12+].
Boro-y kryštalizuje v štruktúre soli Gema, rovnako ako v prípade NaCl. Získajú sa ďalšie alotropy od bóru po vysoké tlaky (20 GPA) a teploty (1800 ° C) a potom zostávajú stabilné za normálnych podmienok. Jeho faktická stabilita konkuruje stabilite β-Romboédrico bóru.
Kubický a amorfný
Ostatné alotropy bóru pozostávajú z agregátov atómov B, akoby boli spojené kovovou väzbou, alebo akoby to boli iónové kryštály; to znamená, že je to kubický bór.
A v neposlednom rade je to amorfný bór, ktorého dispozícia jednotiek B12 Je náhodná a chaotická. Je prezentovaný ako jemný alebo sklovitý prášok tmavých farieb a nepriehľadnú hnedú farbu.
Borofenos
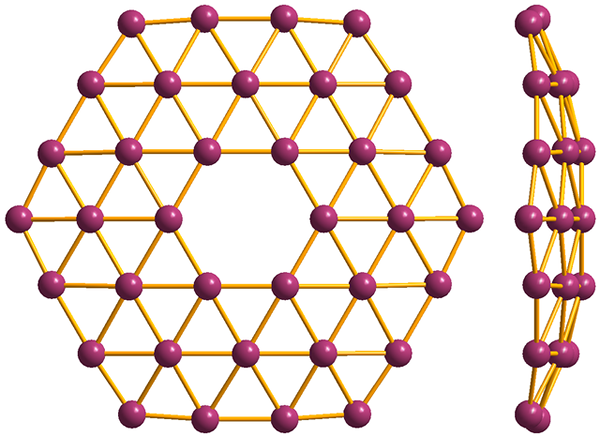 Štruktúra najjednoduchšieho z borofenov, B36. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Štruktúra najjednoduchšieho z borofenov, B36. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] A nakoniec je najpredstarstom a najbizarnejším alotropickým z Boro: borofenos (vyšší obrázok). Skladá sa z opičej vrstvy atómov bóru; extrémne tenký a analogický s grafénom. Všimnite si, že si zachováva slávne trojuholníky, charakteristické pre elektronický nedostatok, ktorý trpia jeho atómy.
Okrem borofenov, z ktorých B36 Je to najjednoduchšie a malé, existujú aj Boroove zhluky. Borosfeén (obrázok nižšie) pozostáva z sférickej klietky podobnej gule štyridsiatich atómov Boro, b40; Ale namiesto toho, aby mali hladké hrany, sú náhle a nepravidelné:
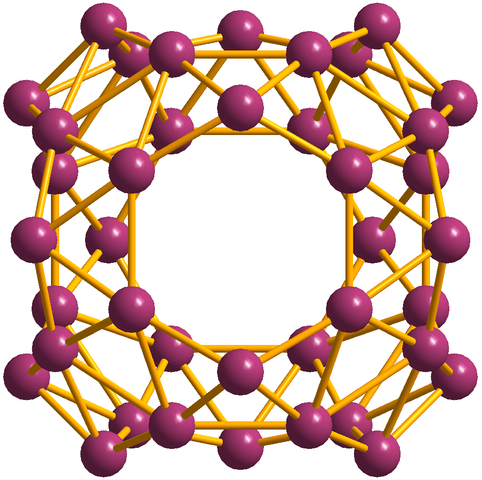 Jednotka Borosferenos, B40. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Jednotka Borosferenos, B40. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Elektronická konfigurácia
Elektronická konfigurácia bóru je:
[On] 2s2 2 P1
Preto tri elektróny z Valencie. Chýba mu ďalších päť na dokončenie svojho okteta vo Valencii a sotva môže vytvárať tri kovalentné putá; Na dokončenie vášho oktetu by som potreboval štvrtý dativový odkaz. Bór môže stratiť svoje tri elektróny, aby získal oxidačný stav +3.
Získanie
Bór je izolovaný redukciou kyseliny boritej pomocou horčíka alebo hliníka; Metóda podobná Gay-Lussac a Thénard. Má náročnosť znečistenia bóru s borurosmi týchto kovov.
Vzorka s vysokou čistotou sa dá získať plynným redukciou bóru trichloridu alebo tribromidu s vodíkom na elektricky tantricky zahrievaných vláknach.
Bór s vysokou čistotou sa pripravuje rozkladom pri vysokých diboránových teplotách, po ktorom nasleduje očistenie fúziou zón alebo czochararalski procesov.
Žiadosti
V priemysle
Elementárny bór sa použil pri tvrdení ocele. V zliatine so železom, ktorá obsahuje 0,001 a 0,005 % bóru. Používa sa tiež v neželeznom priemysle, zvyčajne ako deoxidant.
Okrem toho sa Bór používa ako bahnitý v zliatinách založených na medi a medi s vysokou vodivosťou. V polovodičovom priemysle sa ako dopingové činidlo Silicon a Germanio pridávajú malé množstvá boro.
Môže vám slúžiť: Isopreno: Štruktúra, vlastnosti, aplikácieOxid boro (b2Ani3(.
Boro karbid (B4C) Je to extrémne tvrdá látka, ktorá sa používa ako abrazívne a posilnené činidlo v kompozitných materiáloch. Hliník Boruro (ALB12) Sa používa ako náhrada diamantového prachu za matné a leštené.
Bór sa používa v zliatinách, napríklad v magnetoch vzácnych Zeme, zliatin so železom a neodymiam. Vytvorené magnety sa používajú pri výrobe mikrofónov, magnetických spínačov, slúchadiel a urýchľovačov častíc.
V medicíne
Kapacita izotopu Boro-10 (10B) Na zachytenie neutrónov, emitujúceho žiarenia a -typu sa použilo na liečbu mozgových nádorov v technike známej ako bór neutrónová zachytávajúca terapia (BNCT).
On 10B vo forme zlúčenín sa akumuluje v rakovinovom nádore. Následne je nádorová zóna s neutrónmi vyžarovaná. Tieto interagujú s 10B, čo spôsobuje emisiu a častice a častíc. Tieto častice majú vysoký relatívny biologický účinok a vďaka svojej veľkej veľkosti majú malý dosah.
Takže deštruktívne pôsobenie častíc a je obmedzené v nádorových bunkách, čím sa vykonáva ich deštrukcia. BNCT sa tiež používa pri liečbe nádorov krku, pečene, močového mechúra a prostaty.
Biologické pôsobenie
Pre rast mnohých rastlín je potrebné malé množstvo bórovej kyseliny alebo boreera. Nedostatok bóru sa prejavuje v deformovanom raste rastlín; „hnedé srdce“ zeleniny; a „suchá hniloba“ cukrovej repy.
Bór môže byť potrebný v malom množstve na udržanie zdravia kostí. Existujú štúdie, ktoré naznačujú, že nedostatok bóru by sa zapojil do tvorby artritídy. Zasiahlo by to tiež do mozgových funkcií, ako je pamäť a koordinačný oči.
Niektorí odborníci poukazujú na to, že 1,5 až 3 mg bóru by sa malo zahrnúť do dennej stravy.
Riziká a opatrnosť
Bór, oxid bóru, kyselina boritá a boratá, sa považujú za netoxické. LD50 pre zvieratá je 6 g bóru/kg telesnej hmotnosti, zatiaľ čo látky s LD50 väčším ako 2 g/kg telesnej hmotnosti sa považujú za netoxické.
Na druhej strane, spotreba viac ako 0,5 mg/bóru počas 50 dní spôsobuje menšie tráviace problémy, čo naznačuje toxicitu. Niektoré správy poukazujú na to, že prebytok pri príjme bóru môže ovplyvniť fungovanie žalúdka, pečene, obličiek a mozgu.
Podobne boli v nosohltaní, horných dýchacích ciestch a očami vystavené bóru indikované krátkodobé dráždivé účinky a oči pre vystavenie bóru.
Správy o toxicite bóru sú zriedkavé av mnohých prípadoch sa toxicita prezentuje vo veľmi vysokých dávkach, vyššia ako všeobecná populácia je vystavená.
Odporúčanie je monitorovať obsah bóru v potravinách, najmä zeleniny a ovocia. Vládne zdravotnícke agentúry musia monitorovať, že koncentrácia bóru vody nepresahuje povolené limity.
Pracovníci vystavení prachu obsahujúceho bóru by mali nosiť masky, ktoré chránia dýchací trakt, rukavice a špeciálne topánky.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Alotropy bóru. Zdroj: In.Wikipedia.orgán
- Profesor. Robert J. Lancashire. (2014). Prednáška 5b. Štruktúra prvkov (nemetály, b, c). Katedra chémie, University of West Indies, Mona Campus, Kingston 7, Jamajka. Získané z: Chem.Uwimona.Edu.Jm
- Manisha Lalloo. (28. januára 2009). Objavená štruktúra bóru ultra. Svet chémie. Získané z: Chemistryworld.com
- Zvonenie. (16. decembra 2018). Profil kovového bóru. Získané z: Thebalance.com
- Redaktori Enyclopaedia Britannica. (2019). Bór. Získané z: Britannica.com
- Agentúra pre toxické látky a register chorôb. (2010). Toxfaqs ™ na bóre. [PDF]. Zdroj: ATSDR.CDC.Vláda
- HelMestine, Anne Marie, PH.D. (6. februára 2019). Chemické a fyzikálne vlastnosti bóru. Zotavené z: Thoughtco.com

