Anthraceno Čo je, štruktúra, vlastnosti, používa
- 3864
- 715
- Tomáš Klapka
On Antraén Je to polycyklický aromatický uhľovodík (PAH), ktorý je tvorený fúziou troch benzénových krúžkov. Je to bezfarebná zlúčenina, ale pod ožarovaním ultrafialového svetla získava fluorescenčnú modrú farbu. Antraén ľahko sublimuje.
Je to biela tuhá látka, ale môže sa vyskytnúť aj ako nekolínny bezfarebný kryštály, mäkkého aromatického zápachu. Pevný antraén je prakticky nerozpustný vo vode a je čiastočne rozpustný v organických rozpúšťadlách, najmä pri disulfidu uhlíka, CS2.
Objavil ho v roku 1832 august Laurent a Jean Dumas, použitie dechtu ako suroviny. Tento materiál sa naďalej používa pri výrobe antracénu, pretože obsahuje 1,5 % aromatickej zlúčeniny. Môže sa tiež syntetizovať z benzochinónu.
Nachádza sa v prostredí ako produkt čiastočného spaľovania fosílnych uhľovodíkov. Nachádza sa v pitnej vode, v atmosférickom vzduchu, v úniku motorových vozidiel a v dyme cigariet. Zobrazuje sa v zozname EPA (Agentúra pre ochranu životného prostredia v Spojených štátoch) najdôležitejších znečisťujúcich látok na životné prostredie.
Konštrukcia
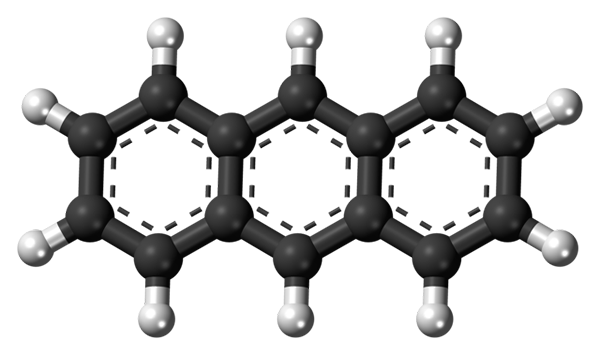 Tri aromatické krúžky antracénu. Zdroj: Jynto [CC0]
Tri aromatické krúžky antracénu. Zdroj: Jynto [CC0] Horný obrázok zobrazuje štruktúru antracenu predstavovaného s guľovými a stĺpcovými modelmi. Ako je zrejmé, existujú tri aromatické krúžky so šiestimi karhónmi; Toto sú benzénové krúžky. Bodkované čiary označujú aromaticitu prítomnú v štruktúre.
Všetky uhlíky majú hybridizáciu SP2, Takže molekula je v rovnakej rovine. Preto možno antracén považovať za malý a aromatický list.
Všimnite si, že atómy vodíka (biele gule) sa prakticky objavujú pred sériou chemických reakcií.
Intermolekulárne sily a kryštalická štruktúra
Antraén. Môžete napríklad vidieť, že dva z týchto „listov“ sa spájajú a posúvajú elektróny svojho π mraku (aromatické centrá prsteňov), dokážu sa držať pohromade.
Ďalšou možnou interakciou je, že vodíny s určitým pozitívnym čiastočným zaťažením sú priťahované k negatívnym a aromatickým centrám susedných antractových molekúl. A preto tieto atrakcie majú smerový efekt, ktorý usmerňuje molekuly antracénu vo vesmíre.
Môže vám slúžiť: Konštantná rýchlosťAntracén sa teda nariaďuje takým spôsobom, že prijíma vzor štruktúry s dlhým rozdielom; A preto môže kryštalizovať v monoklinickom systéme.
Pravdepodobne tieto kryštály vykazujú žltkasté sfarbenie ich oxidácie na Antraquinona; čo je odvodený od antrakénu, ktorého pevná látka je žltá.
Vlastnosti
Chemické názvy
-Antraén
-Paranaftalén
-Antracín
-Zelený olej
Molekulárna receptúra
C14H10 alebo (c6H4Ch)2.
Molekulová hmotnosť
178 234 g/mol.
Fyzický popis
Biela alebo bledožltá pevná látka. Monoklinické kryštály produkt rekryštalizácie alkoholu.
Farba
Keď je čistý, antracén je bezfarebný. So žltými svetlo žltými kryštálmi dávajte fluorescenciu modrej farby. Môžete tiež prezentovať určité žltkasté tóny.
Vôňa
Mäkký aromatický.
Bod varu
341,3 ° C.
Bod topenia
216 ° C.
zapaľovač
250 ° F (121 ° C), zatvorená šálka.
Rozpustnosť
Prakticky nerozpustné vo vode.
0.022 mg/l vody pri 0 ° C
0044 mg/l vody pri 25 ° C.
Rozpustnosť etanolu
0,76 g/kg pri 16 ° C
3,28 g/kg pri 25 ° C. Všimnite si, ako je v etanolu rozpustnejší ako vo vode pri rovnakej teplote.
Rozpustnosť v Hexano
3,7 g/kg.
Rozpustnosť pri benzéne
16,3 g/l. Jeho najväčšia rozpustnosť v benzéne ukazuje jeho vysokú afinitu k nemu, pretože obe látky sú aromatické a cyklické.
Rozpustnosť disulfidu uhlíka
32,25 g/l.
Hustota
1,24 g/cm3 pri 68 ° F (1,25 g/cm3 pri 23 ° C).
Hustota pary
6,15 (so vzduchom považovanými ako referencia rovnajúci sa 1).
Tlak pary
1 mmHg pri 293 ° F (sublima). 6,56 x 10-6 mmHg pri 25 ° C.
Stabilita
Je stabilný, ak je uložený za odporúčaných podmienok. Je triboluminiscenčný a triboelektrický; To znamená, že keď sa trieš, vyžaruje svetlo a elektrinu. Antracén stmavne, keď je vystavený slnečnému žiareniu.
Sebaprečovanie
1.004 ° F (540 ° C).
Rozklad
Vyrábajú sa nebezpečné zlúčeniny spaľovaním (oxidy uhlíka). Rozkladá sa, keď sa zahrieva pod vplyvom silných oxidantov, vytvára aker a toxický dym.
Môže vám slúžiť: nitrobenzén (C6H5N2): Štruktúra, vlastnosti, použitia, rizikáSpaľovacie teplo
40110 kJ/kg.
Kaliforka
210,5 j/mol · k.
Maximálna absorpčná vlnová dĺžka (viditeľné svetlo a ultrafialové)
Maximálne λ 345,6 nm a 363,2 nm.
Hrebeň
-0,602 CPoise (240 ° C)
-0,498 CPoise (270 ° C)
-0,429 CPoise (300 ° C)
Ako je vidieť, jeho viskozita sa znižuje so zvyšovaním teploty.
Menovanie
Anthracén je rovnomerná polycyklická molekula a podľa nomenklatúry stanovenej pre tento typ systému by jej skutočný názov mal byť trikrát. Predpona Tri je spôsobená skutočnosťou, že existujú tri beancenické krúžky. Triviálny názov antracene však rozšíril a zakorenil v populárnej a vedeckej kultúre.
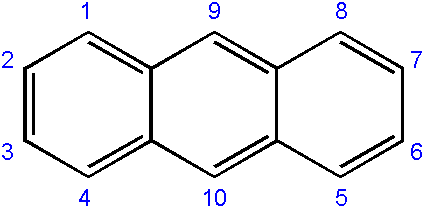
Nomenklatúra zlúčenín odvodených z nich je zvyčajne trochu zložitá a závisí od uhlíka, kde sa vyskytuje výmena. Nasledujúce ukazuje príslušné číslovanie uhlíkov pre anthract:
 Číslovanie uhlíkov v antracéne. Zdroj: EDGAR181 [verejná doména]
Číslovanie uhlíkov v antracéne. Zdroj: EDGAR181 [verejná doména] OBJEDNÁVKA ČÍSLO je spôsobená prioritou reaktivity alebo náchylnosti uvedených uhlíkov.
Karbóny koncov (1-4 a 8-5) sú najaktuálnejšie, zatiaľ čo karty v strede (9-10) reagujú cez iné podmienky; Napríklad oxidačný, za vzniku antrachinónu (9, 10-dioxontracén).
Toxicita
V kontakte s pokožkou môže spôsobiť podráždenie, svrbenie a pálenie, ktoré sa zhoršuje slnečným svetlom. Anthracén je fotosenzibilizátor, ktorý zvyšuje poškodenie kože spôsobené UV žiarením. Môže spôsobiť akútnu dermatitídu, teangiektáziu a alergiu.
V kontakte s očami môže spôsobiť podráždenie a horieť. Dýchací antraén môže dráždiť nos, hrdlo a pľúca, čo spôsobuje kašeľ a pískanie.
Príjem antracénu bol spojený u ľudí s bolesťou hlavy, nevoľnosťou, stratou chuti do jedla, zápalom gastrointestinálneho traktu, pomalými reakciami a slabosťou.
Boli návrhy na rakovinu pôsobenie antrakénov. Táto domnienka však nebola potvrdená, vrátane niektorých derivátov antracénu sa použila pri liečbe určitých typov rakoviny.
Žiadosti
Technologický
-Anthracén je organický polovodič, ktorý sa používa ako spindr vo vysoko -energetických fotónoch, elektronoch a alfa častíc.
-Používa sa tiež na plastový povlak, ako je polyvinaluén. To s cieľom produkovať plastové vreteše s vodnými charakteristikami, ktoré ich používajú v dozimetrii rádioterapie.
Môže vám slúžiť: piperidín: štruktúra, syntéza, deriváty, reakcie-Antracén sa bežne používa ako plotter UV žiarenia, aplikovaný v povlakoch v doskách s obvodmi. To umožňuje skontrolovať podšívku s ultrafialovým svetlom.
Samostatná molekula
V roku 2005 chemici Kalifornskej univerzity v Riverside syntetizovali prvú štandardnú molekulu: 9.10-ditioantratón. Toto je tlačené v priamke, keď sa zahrieva na plochom povrchu medi a môže sa pohybovať, akoby mal dve nohy.
Vedci si mysleli, že molekula je potenciálne použiteľná pri molekulárnych výpočtoch.
Piezokromaticita
Niektoré deriváty antracénu majú piezochromatické vlastnosti, to znamená, že majú schopnosť meniť farbu v závislosti od tlaku, ktorý sa používa. Preto sa môžu použiť ako tlakové detektory.
Antracén sa používa aj pri vypracovaní So -založených dymových obrazoviek.
Ekologický
Politické aromatické uhľovodíky (PAH) sú znečisťujúce environmentálne znečisťujúce látky, najmä z vody, takže sa vyvíja úsilie na zníženie toxickej prítomnosti týchto zlúčenín.
Antracén je materiál (PAH) a používa sa ako model na štúdium použitia metódy pyrolýzy vody pri degradácii zlúčenín PAH.
Vodná pyrolýza sa používa pri čistení priemyselnej vody. Jeho účinok na antraén produkoval tvorbu oxidačných zlúčenín: antrron.
Tieto výrobky sú menej stabilné ako antracén, a preto sú v prostredí menej pretrvávajúce, a preto je možné ľahšie eliminovať ako zlúčeniny PAH.
Ďalší
-Antracén oxiduje, aby vznikol anthrochinón, ktorý sa používa pri syntéze farbív a farbív
-Antracén sa používa na ochranu dreva. Používa sa tiež ako insekticíd, mozgová príhoda, herbicíd a raticid.
-Antracyklín antibiotikum sa používa pri chemoterapii, pretože inhibuje syntézu DNA a RNA. Molekula antracyklínu je rozptýlená medzi bázami DNA/RNA, čo inhibuje replikáciu rýchlo rastúcich rakovinových buniek.
Odkazy
- Antraén. Zdroj: In.Wikipedia.orgán
- Antraén. Získané z: pubchem.Ncbi.NLM.NIH.Vláda

