Amfotery, ktoré sú, typy a príklady
- 3951
- 440
- Ing. Ervín Petruška
Ten Amfostery Sú to zlúčeniny alebo ióny, ktoré majú zvláštnosť, že sa môžu správať ako kyselina alebo báza, podľa Bronstedovej a Lowryovej teórie. Jeho meno pochádza z gréckeho slova Amfoteroi, čo znamená „oboje“.
Mnoho kovov tvorí oxidy amfoteros alebo hydroxidy vrátane meďnatého, zinku, cín, olova, hliníka a berylia. Charakteristika amfoter týchto oxidov závisí od oxidačných stavov daného oxidu. Na konci článku sú zahrnuté príklady týchto látok.

Oxidy kovov, ktoré môžu reagovať s kyselinami a bázami, aby sa vytvorili soli a voda sa nazýva oxidy amfoteros. Oxidy olova a zinočnatého sú veľmi dobrým príkladom, okrem iných zlúčenín.
[TOC]
Čo sú amfoter?
Podľa teórie Bronsted a Lowryho kyslej bázy sú kyseliny tie látky, ktoré darujú protóny, zatiaľ čo základy sú tie, ktoré prijímajú alebo berú protóny.
Molekula nazývaná amfotát bude mať reakcie, pri ktorých získa protóny, pretože bude mať tiež schopnosť ich darovať (hoci to nie je vždy tak, ako bude vidieť v nasledujúcej časti).
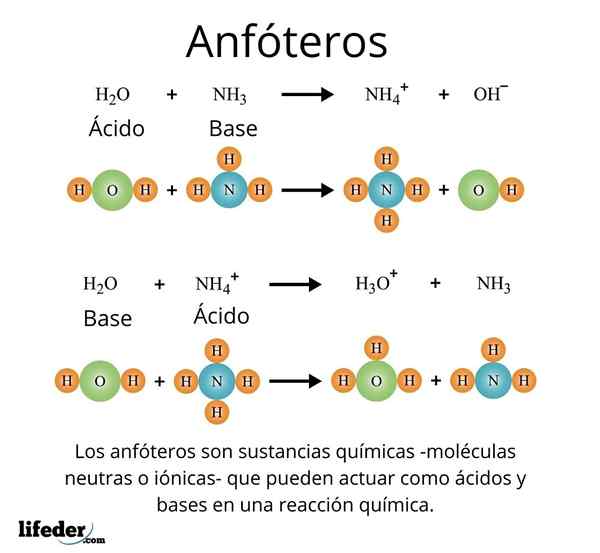
Dôležitým a dobre známym prípadom je prípad univerzálneho rozpúšťadla, voda (h₂o). Táto látka ľahko reaguje s kyselinami, napríklad pri reakcii s kyselinou chlorovodíkovou:
H2O + HCI → H3Ani+ + Cl-
Ale na druhej strane nemá problémy s reagovaním so základňou, ako v prípade amoniaku:
H2O + nh3 → NH4 + Oh-
S týmito príkladmi sa dá poznamenať, že voda pôsobí úplne ako látka amfotátu.
Typy amfoterov
Aj keď amfotentné látky môžu byť molekuly alebo ióny, existujú molekuly, ktoré najlepšie demonštrujú amfotentné charakteristiky a pomáhajú lepšie študovať toto správanie: amfrofrotické látky. Toto sú molekuly, ktoré môžu špecificky darovať alebo akceptovať protón pôsobiť ako kyselina alebo báza.
Môže vám slúžiť: Rodio: História, vlastnosti, štruktúra, použitie, rizikoMalo by sa objasniť, že všetky amfotické látky sú amfotické, ale nie všetky amfotre sú amfiprtické; Existujú amfotory, ktoré nemajú protóny, ale môžu sa správať ako kyseliny alebo základne iným spôsobom (napríklad Lewisova teória).
Medzi amfiprtické látky patrí voda, aminokyseliny a hydrogenuhličitan a sulfátové ióny. Amfrofotické látky sú zase tiež subklasifikované podľa ich schopnosti darovať alebo výnosy protónov:
Látky protogénnej alebo kyseliny amfiprytovej
Sú tí, ktorí majú väčšiu tendenciu dať protón, ako ho prijať. Medzi nimi patrí kyselina sírová (H2SW4) a kyselina octová (CHO3Cooh), okrem iného.
Základné protofilné alebo amfotické látky
Sú to tí, pre ktoré akceptujú protón, je častejšie ako jeho výnos. Medzi týmito látkami nájdete amoniak (NH3) a etylendiamid [c2H4(NH2)2].
Neutrálne látky
Majú rovnakú ľahkosť alebo schopnosť prijať protón, aby sa ho vzdal. Medzi nimi patrí voda (h2O) a menšie alkoholy (-ROH), hlavne.
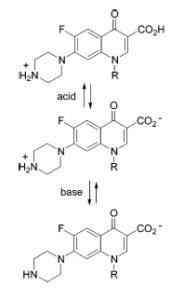 Ampotero charakter chinolónov
Ampotero charakter chinolónov Príklady amfotentných látok
 Napätie
Napätie Teraz ste už opísali amfotentné látky, je potrebné označiť príklady reakcií, v ktorých sú tieto charakteristiky prezentované.
Ión kyseliny uhličitej predstavuje základný prípad amfiprtickej látky; Potom sú ich reakcie reprezentované, keď pôsobí ako kyselina:
HCO3- + Oh- → CO32- + H2Ani
Ďalšia reakcia nastane, keď pôsobí ako základ:
HCO3- + H3Ani+ → H2Co3
Existuje tiež mnoho ďalších látok. Z toho sú nasledujúce príklady:
Oxidy amfoterov
Oxid zinočnatého, ako už bolo spomenuté, je amfotero, ale nie amfiprtická látka. Ďalej je demonštrované prečo.
Môže vám slúžiť: Justus von LiebigSprávanie sa ako kyselina:
ZnO + H2SW4 → Znso4 + H2Ani
Správanie sa ako základňa:
ZnO + 2naoh + h2O → na2[Zn (OH)4]
Oxid olovo (PBO), hliník (AL2Ani3) a Tin (SNO) majú tiež svoje vlastné amfotentné charakteristiky:
Správanie sa ako kyseliny:
PBO + 2HCL → PBCL2 + H2Ani
Do2Ani3 + 6HCl → 2ALCL3 + 3h2Ani
Sno + hcl ↔ sncl + h2Ani
A ako základy:
PBO + 2NAOH + H2O → na2[PB (OH)4]
Do2Ani3 + 2AOH + 3H2O → 2na [AL (OH)4]
Sno + 4naoh + h2Alebo ↔ na4[Sn (oh)6]
Existujú tiež oxidy amfoteros z galy, indického, škandialku, titánu, Circonium, vanadium, chróm, železo, kobalt, meď, striebro, zlato, Germanio, antimón, bizmut, bizmut, bizmut. a telurio.
Hydroxidy Anfoter
Hydroxidy môžu tiež prezentovať amfotentné charakteristiky, napríklad v prípadoch hydroxidu hlinitého a berýlia. Obidva príklady sú pozorované nižšie:
Hliníkový hydroxid ako kyselina:
Al (oh)3 + 3HCl → ALCL3 + 3h2Ani
Hliníkový hydroxid ako základ:
Al (oh)3 + NaOH → Na [Al (OH)4]
Hydroxid berylium ako kyselina:
Byť (oh)2 + 2HCl → Becl2 + H2Ani
Hydroxid berylium ako základ:
Byť (oh)2 + 2NAOH → NA2[Buď (oh)4]
Rozdiely medzi amfoterami, amphiprtický
Je potrebné vedieť, ako rozlíšiť koncept každého pojmu, pretože jeho podobnosť sa môže stať mätúcou.
Je známe, že amfotory sú látky, ktoré sa správajú ako kyseliny alebo bázy v reakcii, ktorá produkuje soľ a vodu. Môžu to urobiť na darovanie alebo zachytenie protónu, alebo jednoducho prijatím elektronického krútiaceho momentu (alebo ho) podľa Lewisovej teórie.
Na druhej strane sú amfotické látky tie amfotéri, ktorí pôsobia ako kyseliny alebo základne s darom alebo zbierkou protónu, podľa zákona Bronsted-Lowryho zákona. Všetky amfotické látky sú amfotické.
Môže vám slúžiť: benzoín: štruktúra, vlastnosti, použitia a rizikáAmpolitické zlúčeniny sú amfotentné molekuly, ktoré existujú ako zwitterióny a majú dipólové ióny v určitých fyzoch pH. Používajú sa ako tlmenia v nárazníkových roztokoch.
Nakoniec, rozpúšťadlá stláčania sú tí, ktorí nemajú protóny, ktoré sa môžu vzdať, a nemôžu ich ani prijať.
Odkazy
- Amfoterický. (2008). Wikipedia. Získané z in.Wikipedia.orgán
- Anne Marie HelMestine, P. (2017). Čo znamená amfoterický v chémii?. Získané z ThoughtCo.com
- Bicpuc. (2016). Amfoterické zlúčeniny. Získané z medum.com
- Chemickolák. (s.F.). Definícia amfoterického. Získané z chemického kolaky.com.

