Amidas
- 2450
- 207
- JUDr. Rudolf Čapkovič
Vysvetľujeme, čo sú uprostred, ich charakteristiky, štruktúra, typy, nomenklatúra a uvádzame niekoľko príkladov
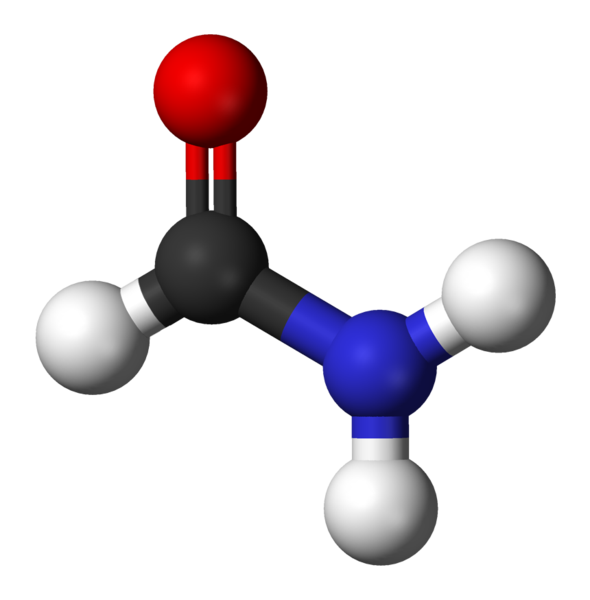
 Formamid, najjednoduchší Amida
Formamid, najjednoduchší Amida Čo sú Amidas?
Amidas je typ organických zlúčenín, ktoré sú tvorené spojením medzi kyselinou karboxylovou a amínom. Nazývajú sa tiež kyslé amíny a odtiaľ je presne odkiaľ slovo pochádza amid.
Tieto zlúčeniny sú veľmi dôležité pre život, pretože sú nevyhnutnou súčasťou proteínov, peptidov a niektorých hormónov. Sú tiež súčasťou dusíkatých báz DNA a RNA, ktoré obsahujú naše genetické informácie.
Amidas je tiež veľmi dôležitý v priemysle. Napríklad, Nylon Je to jeden z najpoužívanejších syntetických vlákien na celom svete a je tvorený dlhým reťazcom United amides jeden za druhým.
Amidy sa tiež používajú vo farmaceutickom priemysle, pretože sú súčasťou liekov, ako je lidokaín.
Charakteristiky amidov
- Takmer všetky sú solídne: Všetky amidy sú pevné pri teplote miestnosti, s výnimkou najmenších a najjednoduchších, čo je formamid. Ten je tekutý.
- Majú vysoký bod varu: V porovnaní s karboxylovými kyselinami a amínmi, z ktorých sa vyrábajú, majú amidy vysoký bod varu. Napríklad acetamid (zvoľte3Conh2) Je tvorená spojením kyseliny octovej (ocot) s amoniakom. Bod acetamidu varu je 221,2 ° C, zatiaľ čo v kyseline octovej je 118 ° C a amoniak je -33,34 ° C.
- Niektoré sú rozpustné vo vode: Najmenší uprostred amidas sa dobre premieša s vodou, takže je ľahké ich v nej rozpustiť. Avšak, keď sa zväčšujú, stávajú sa menej rozpustnými.
- Sú menej základné ako amíny: Amida je vždy menej základná (alebo kyslejšia) ako amín, z ktorého vychádza. V skutočnosti názov Amida pochádza z kombinácie jaNa+ACIdávať.
- Váš odkaz je ľahko prerušený: Ak sa pridá silná báza ako katalyzátor, amidy reagujú rýchlo s vodou. Táto reakcia sa nazýva hydrolýza a počas toho je Amida zlomená, aby sa vytvorila pôvodná kyselina a amín.
- Sú to bezfarebné a toalety: Všeobecne platí, že amidy sú látky, ktoré nemajú farbu alebo charakteristický zápach.
Štruktúra funkčnej skupiny
Chemicky je Amida funkčná skupina, ktorá obsahuje karbonylovú skupinu (C = O) z karboxylovej kyseliny, ktorá je spojená s dusíkmi z amoniaku alebo amínu. Všeobecná štruktúra amidov je:
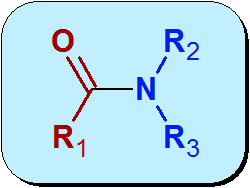 Červená časť molekuly v predchádzajúcom obrázku pochádza z karboxylovej kyseliny a nazýva sa to Acyl. Modrá časť pochádza z Amida.
Červená časť molekuly v predchádzajúcom obrázku pochádza z karboxylovej kyseliny a nazýva sa to Acyl. Modrá časť pochádza z Amida.
Charakteristiou štruktúry uprostred, ktoré ich odlišujú od amínov, je to, že pár voľných elektrónov, ktoré ich dusík vlastní v karbonylovej skupine prostredníctvom procesu nazývaného rezonancia. To je dôvod, prečo sú uprostred menej základné ako amíny.
Typy amidov
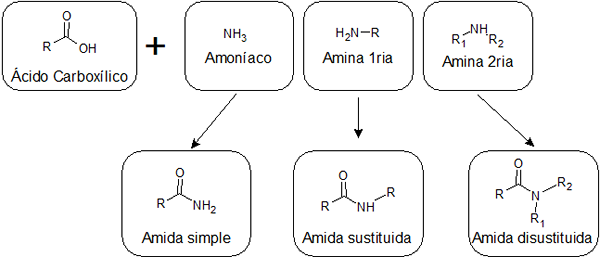
V závislosti od toho, či je kyselina kombinovaná s amoniakom, s primárnou aminou alebo so sekundárnym amínom, je možné získať tri typy amidov s rôznymi štruktúrami:
Jednoduché amidy
Tvoria ich spojenie medzi kyselinou karboxylovou a amoniakom. Tento typ Amida má skupinu -nh2 Spojené so skupinou karbonyl. Jednoduché amidy môžu navzájom tvoriť niekoľko vodíkových väzieb a vodou, takže sú zvyčajne rozpustnejšie ako tie, ktoré sú vymenené.
- Jednoduché príklady Amida: formamid, acetamid a butyramid.
Vymenené amidy
Sú získané spojením kyseliny a primárneho amínu. V tomto prípade jeden z hydrogénov -nh2 Z jednoduchých amidov je nahradený alkylom, a preto sa im hovorí, že nahradené.
- Príklad vymeneného amidu: Spojenie medzi aminokyselinami v proteínoch.
Nepochybné amidy
Pochádzajú z reakcie medzi kyselinou a sekundárnym amínom. V tomto prípade oba hydrogény skupiny -NH2 Sú nahradené alkylovými skupinami. Nesúhlasené amidy nemajú vodík pripojený k dusičnanom, takže nemôžu navzájom tvoriť vodíkové mosty a iba jeden slabý s vodou. Vďaka tomu sú menej rozpustné vo vode ako iné druhy amidov.
Laktámy, primárne, sekundárne a terciárne amidas
Okrem troch typov novo spomínaných amidov tiež existujú Primárne, sekundárne a terciárne amidy, ktoré sa líšia tým, že majú jednu, dve alebo tri kyslé skupiny zjednotené s atómom dusíka.
Nakoniec niektoré amidy tvoria uzavreté cykly. V tomto prípade sa zlúčenina nazýva laktám. Laktámy sú svojou povahou veľmi dôležité. Napríklad uracil, ktorý je súčasťou RNA, je laktám.
Nomenklatúra Amidas
Jednoduché amidy
Jednoduché amidy sú pomenované z názvu uhlíkového reťazca kyseliny, z ktorej pochádzajú (hlavný reťazec). Názov je vytvorený umiestnením predpony označujúcej počet uhlíkov (Methan-, butan-, hexan- atď.) alebo spoločný názov kyseliny odstránením ukončenia -oico alebo -ico (ako v ACétICO) A pridanie ukončenia -amida.
- Príklad: Amid, ktorý pochádza z kyseliny octovej, sa nazýva acetamid a ten, ktorý pochádza z kyseliny propanóovej, sa nazýva propanamid.
Vymenené a nepríjemné amidy
V tomto prípade sa začína menovaním alkylových skupín, ktoré sú spojené s dusík, predchádzajúce písmeno n-. Potom je zvyšok Amida pomenovaný ako hlavný reťazec.
Môže vám slúžiť: Síra: História, vlastnosti, štruktúra, získavanie, použitie, použitiaPríklad:
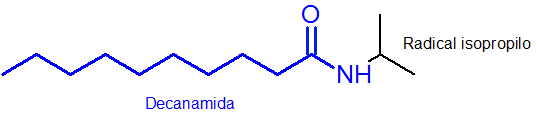 Ako je zrejmé, substituent, ktorý je pripojený k dusíku, je izopropylová skupina, takže je zahrnutá v názve ako n-okosopropyl (posledný „O“ je vždy odstránený do názvu radikálu).
Ako je zrejmé, substituent, ktorý je pripojený k dusíku, je izopropylová skupina, takže je zahrnutá v názve ako n-okosopropyl (posledný „O“ je vždy odstránený do názvu radikálu).
Zvyšok hlavného reťazca, ktorý má funkčnú skupinu Amida, má 10 atómov uhlíka. To znamená, že vaše meno musí mať predponu, po ktorej nasleduje ukončenie Amida alebo, dekanamid. Takže on Celé meno je n-osopropildecanamid.
Príklady amidov
- Benzamid c6H5Conh2
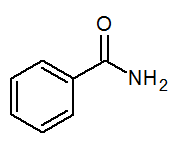
- N, N-dimetylacetamid CH3S (ch3)2
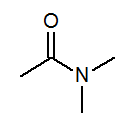
- Acetamid3Conh2
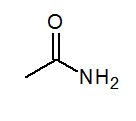
- Fenylacetamid (c6H5)2Conh2
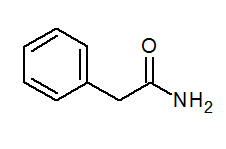
- N-butil-n-propilformamid HCON (C3H7) (C4H9)
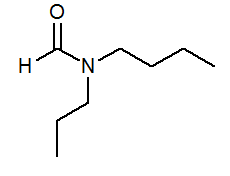
- 4-hydroxybanamid ch2(Oh) Cho2Chvály2Conh2
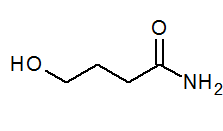
- Močovina Co (NH2)2
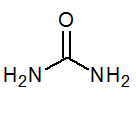
- Propanamid ch3Chvály2Conh3
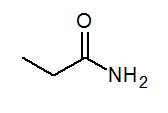
- N-Butil-2-EchopilpetanAmida CH3Chvály2Chvály2CH (C3H7) Conh (c4H9)

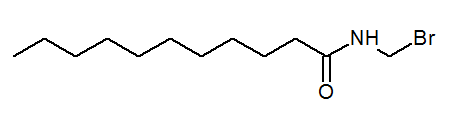
- N- (bromometyl) undekanamid Cho3(Ch2)9Zraziť2Br
Odkazy
- Britannica, T. Redaktori encyklopédie (2019, 15. mája). Amid. Encyclopedia Britannica. Prevzaté z Britannice.com
- Amis-štruktúry a mená. (2020, 17. augusta). Prevzaté z Chem.Librettexts.orgán
- Carey, f. Do. (2008). Organická chémia. Boston: McGraw-Hill Higher Education.
- Smith, m., Marec, j., & Marec, J. (2001). Advanced Organic Chemistry: Lac. New York: Wiley.
- Zabicky, J. (1970). Chémia Amis, 1. časť. New York: Wiley

