Alkíny
- 1158
- 204
- MUDr. Miloslav Habšuda
 Alvento štruktúra, s trojitým odkazom
Alvento štruktúra, s trojitým odkazom Čo sú Alkines?
Ten Alkíny Sú to uhľovodíky alebo organické zlúčeniny, ktoré v ich štruktúrach prítomné trojnásobné spojenie medzi dvoma uhlíkmi. Tento trojitý odkaz (≡) sa považuje za funkčnú skupinu, keď predstavuje aktívne miesto molekuly, a preto je zodpovedný za ich reaktivitu.
Aj keď alkíny príliš nerozlišujú od Alko alebo alkénov, vykazujú väčšiu kyslosť a polaritu v dôsledku povahy ich väzieb. Presný pojem na opis tohto mierneho rozdielu je to, čo sa nazýva ako nenasýtenie.
Alkány sú nasýtené uhľovodíky, zatiaľ čo alkíny sú najviac nenasýtené vzhľadom na pôvodnú štruktúru. Čo to znamená? Že alkán h3C-C-CH3 (etán) môže byť dehydrogén do h2C = ch2 (etene) a následne HC≡CH (etino alebo lepšie známe ako acetylén).
Všimnite si, ako sa tvoria ďalšie odkazy medzi uhlíkmi znižuje počet vodíkov spojených s nimi. Uhlík sa vďaka svojim elektronickým charakteristikám snaží vytvoriť štyri jednoduché spojenia, takže čím väčšia je tendencia reagovať (s výnimkou aromatických zlúčenín).
Na druhej strane, trojitý odkaz je oveľa silnejší ako dvojitý (=) alebo jednoduchý (-) dlhopis, ale pri vysokých nákladoch na energiu. Preto väčšina uhľovodíkov (alkany a alkény) môže pri vysokých teplotách vytvárať trojité väzby.
V dôsledku ich vysokých energií, keď sa lámajú veľmi horúce. Príklad tohto fenoménu je možné vidieť, keď sa použije acetylén s kyslíkom a použije sa intenzívne teplo plameňa na zváranie alebo roztopenie kovov.
Acetylén je najjednoduchší a najmenší alkín zo všetkých. Ostatné uhľovodíky môžu byť vyjadrené z ich chemického vzorca nahradením H alquilitickými skupinami (RC≡CR '). To isté sa deje vo svete organickej syntézy prostredníctvom veľkého počtu reakcií.
Toto alkíny sa vyskytuje z reakcie oxidu vápenatého vápenca a coque, suroviny, ktorá poskytuje potrebné uhlíky vo vnútri elektrickej rúry:
CAO + 3C => CAC2 + Co
CAC2 Je to karbid vápenatý, anorganická zlúčenina, ktorá konečne reaguje s vodou za vzniku acetylénu:
Kac2 + 2h2O => CA (OH)2 + Hc≡ch
Fyzikálne a chemické vlastnosti alkínov
Polarita
Triple Link odlišuje alkíny od alkanov a alkénov. Tri typy uhľovodíkov sú apolárne, nerozpustné vo vode a veľmi slabé kyseliny. Elektronegativita uhlíkov s dvojitým a trojitým väzbám je však väčšia ako v prípade jednoduchých uhlíkov.
Podľa toho, uhlíky susediace s výťažkom trojitého väzby na hustotu negatívneho zaťaženia negatívneho účinku. Z tohto dôvodu, kde sú odkazy C≡C alebo C = C, budú väčšia elektronická hustota ako vo zvyšku sýtenej kostry. V dôsledku.
Tieto interakcie sú veľmi slabé, ak sa ich dipólové momenty porovnávajú s momentmi molekuly vody alebo akéhokoľvek alkoholu. To sa odráža vo svojich fyzikálnych vlastnostiach: Alkíny majú vo všeobecnosti vyššie body fúzie a varu v porovnaní s bodmi svojich menej nenasýtených uhľovodíkov.
Môže vám slúžiť: 7 najdôležitejších žiadostí o biochémiuPodobne sú kvôli svojej nízkej polarite menej nerozpustné vo vode, ale rozpustné v apolárnych organických rozpúšťadlách, ako je benzén.
Kyslosť
Táto elektronegativita tiež spôsobuje vodík HC≡Cr je kyslejší ako ktokoľvek prítomný v iných uhľovodíkoch. Preto sú alkíny druhy kyslejšie ako alkény a oveľa viac ako alkány. Jeho kyslosť však zostáva opovrhnutia v porovnaní s kyselinami karboxylových kyselín.
Pretože alkíny sú veľmi slabé kyseliny, reagujú iba s veľmi silnými základňami, ako je sodík amiduro:
HC≡CR + NANH2 => HC≡CNA + NH3
Z tejto reakcie sa získa roztok sodnej acetylure, surovina pre syntézu iných alkínov.
Reaktivita Alquinos
Reaktivita alkínov je vysvetlená pridaním malých molekúl k ich trojitému spojeniu, čím sa znižuje jeho nenasýtenie. Môžu to byť molekuly vodíka, vodíkové hallogididy, voda alebo halogény.
Hydrogentácia
Malá H molekula2 Je to veľmi nepolapiteľné a rýchle, aby sa zvýšilo šance na pridanie do trojitého spojenia alkinov.
Zvyčajne sú to kovy (PD, PT, RH alebo Ni) jemne rozdelené na zvýšenie povrchovej plochy; A tak, kontakt medzi vodíkom a Alquinom:
Rc≡cr ' + 2h2 => Rch2Chvály2R '
Výsledkom je, že vodík je „kotvou“ k uhlíkom, ktorý prelomí väzbu, a tak ďalej, až kým zodpovedajúca alkána produkuje, RCH2Chvály2R '. To nielen nasýti počiatočný uhľovodík, ale tiež modifikuje jeho molekulárnu štruktúru.
Pridanie vodíka halogenuróz
Tu sa pridá anorganická molekula HX, kde x môže byť ktorýkoľvek z halogénov (F, Cl, Br alebo I):
Rc≡cr ' + hx => rch = cxr'
Hydratácia
Hydratácia alkínov je, keď pridávajú molekulu vody za vzniku aldehydu alebo ketónu:
Rc≡Cr ' + h2O => rch2Utrpenie
Ak je r 'H, je to aldehyd; Ak je to nájomné, potom je to Cetona. V reakcii sa zlúčenina známa ako enol (rch = c (OH) r ') tvorí ako sprostredkovateľ.
To trpí konverziou enolovej formy (C-OH) na ketón (c = o) v rovnováhe nazývanej tautomerizácia.
Pridanie halogénov
A vzhľadom na prírastky, diatomické molekuly halogénov môžu byť tiež ukotvené k uhlíkom (x x2= F2, Cl2, Br2 počul som2):
Rc≡Cr ' + 2x2 => Rcx2-Cx2R '
Acetylénová alkylácia
Z roztoku acetylu sodného je možné pripraviť ďalšie alkíny pomocou halogenidu prenájmu:
HC≡CNA + RX => HC≡CR + nax
Napríklad, ak by to bol metyljodid, potom by výsledný alkyn bol:
HC≡CNA + CH3I => hc≡cch3 + Nax
Hc≡cch3 je správny, tiež známy ako Metylacetylén.
Chemická štruktúra alkín
 Chemická štruktúra alquino
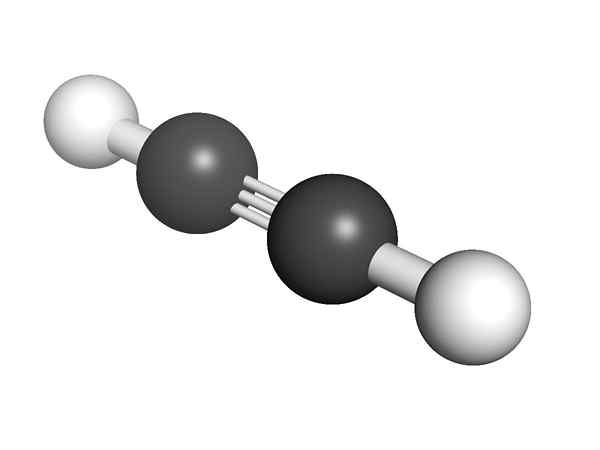
Chemická štruktúra alquino Aká je štruktúra alkínov? Na hornom obrázku je znázornená molekula acetylénu. Lineárna geometria odkazu C≡C môže byť z nej jasná.
Preto, ak je trojnásobná väzba, štruktúra molekuly musí byť lineárna. Toto je ďalší z pozoruhodných rozdielov medzi nimi a zvyškom uhľovodíkov.
Môže vám slúžiť: cykopropán (C3H6)Alkány sú zvyčajne reprezentované ako kľukatá, pretože majú hybridizáciu SP3 a ich odkazy sú oddelené 109 °. Sú to vlastne kovalentne zjednotená reťazec Tetrahedra. Zatiaľ čo alkény sú ploché hybridizáciou SP2 jeho uhlíkov, konkrétnejšie tvoriace trigonálna rovina s oddelenými väzbami o 120 °.
V alkynes je orbitálna hybridizácia SP, to znamená, že majú 50% S a 50% P. Existujú dva hybridné orbitály SP, ktoré sú spojené s atómami H v skupinách acetylénu alebo alkínových skupín v alkine.
Vzdialenosť H alebo R je 180 °, okrem skutočnosti, že iba týmto spôsobom môžu orbitály čistých uhlíkov vytvoriť trojnásobnú väzbu. Z tohto dôvodu je odkaz -c≡c- lineárny. Vidieť štruktúru akejkoľvek molekuly, ktoré sa zdôrazňujú -c≡c- v tých oblastiach, kde je kostra veľmi lineárna.
Vzdialenosť od prepojení a terminálových almužnych
Uhlíky v trojnásobnej väzbe sú v menšej vzdialenosti ako v dvojitom alebo jednoduchom spojení. Inými slovami, C≡C je kratší ako c = c a že c-c. Výsledkom je, že spojenie je silnejšie, pretože dve odkazy π prispievajú k stabilizácii jednoduchého spojenia σ.
Ak je trojnásobná väzba na konci reťazca, potom je to terminálny alkín. Preto musí byť vzorec uvedenej zlúčeniny HC≡CR, kde H poznamenáva koniec alebo začiatok reťazca.
Ak je to naopak, je to trojitý vnútorný odkaz, vzorec je rc≡cr ', kde r a r' sú pravou a ľavou stranou reťazca.
Nomenklatúra Alquinos
Ako sú Alkines vymenované podľa pravidiel diktovaných IUPAC? Rovnakým spôsobom, ako boli vymenovaní Alquenos a Alkény. Za týmto účelom sa zmení prípona -ano alebo -eno pre príponu -ino.
Napríklad: HC≡CCH3 Je vymenovaný za tipy, pretože má tri uhlíky, napríklad propán (Cho3Chvály2Chvály3). HC≡CCH2Chvály3 Je to 1-butino, ktorý je terminálnym alkínom. Ale v prípade Cho3C≡cch3 Toto je 2-butino, a v tomto Triple Link nie je terminál, ale vnútorný.
CH3C≡cch2Chvály2(Ch3)2 Je to 5-metyl-2-hexín. Karbóny začínajú zo strany najbližšie k trojitým odkazom.
Ďalším typom alkín sú cykloalquíny. Pre nich stačí nahradiť príponu -ano -oinom zodpovedajúceho cykloalcanu. Cyklopropán, ktorý má trojnásobnú väzbu, je teda pomenovaný ako cyklopropín (ktorý neexistuje).
Ak sú k dispozícii dva trojité odkazy, k názvu sa pridá predpona DI-. Má ako príklady HC≡C-C-C≡H, diaacetylén alebo propsadín; A HC≡C-C-C-C≡H, butadiino.
Alquinos používa
Acetylén alebo etino
Najmenší z alkínov zahusťuje možný počet použití týchto uhľovodíkov. Z toho je možné syntetizovať ďalšie organické zlúčeniny. Podlieha tiež oxidačný.
Môže vám slúžiť: lítium hydrid: Štruktúra, vlastnosti, získanie, použitieIné z jeho použití spočíva v poskytovaní zdroja tepla na vzrušenie elektrónov atómov; Konkrétnejšie, E kovových katiónov pri stanovovaní atómovej absorpčnej emisie, široko používanej spektroskopickej techniky.
Prírodné alkiny
Jediné existujúce metódy na prípravu alkínov nie sú iba syntetické alebo s tepelnou aplikáciou v neprítomnosti kyslíka, ale aj biologické.
V týchto enzýmoch nazývaných acetylský, ktoré môžu poprieť dvojité puto. Vďaka tomu sa dosahuje veľa prírodných zdrojov alkínov.
Po tom môžu byť tieto zdroje extrahované jedy, antidoty, lieky alebo akúkoľvek inú zlúčeninu, ktorá poskytuje akýkoľvek výhoda; najmä keď sa týka zdravia. Alternatívy je veľa pri úpravách svojich pôvodných štruktúr a ich podpore nových alkinov.
Príklady alkínov
Doteraz bolo spomenuté početné príklady alkínov. Niektoré však pochádzajú z veľmi špecifických zdrojov alebo majú konkrétne molekulárne štruktúry: sú to polyacetylov.
To znamená, že môže existovať viac ako trojnásobné spojenie, ktoré je súčasťou veľmi veľkej štruktúry, a to nielen jednoduchého sýteného reťazca.
Kyselina tarirová
 Štruktúra kyseliny
Štruktúra kyseliny Kyselina tarirová pochádza z rastliny umiestnenej v Guatemale zvanej picramnia tariri. Je špeciálne extrahovaný z oleja zo semien.
Vo svojej molekulárnej štruktúre je možné pozorovať jediné trojité spojenie, ktoré oddeľuje apolárny chvost od polárnej hlavy; Preto by sa dalo považovať za amfipatickú molekulu.
Histrionikotoxín
 Štruktúra histrionikotoxínov
Štruktúra histrionikotoxínov Histrionicotoxín je jedom segregovaný kožou obyvateľov Kolumbie, Brazílie a ďalších krajín Latinskej Ameriky. Má dve trojité konjugované odkazy s dvojitou väzbou. Obidve sú terminály a sú oddelené šesť -karbonovým krúžkom a cyklickým amínom.
Cicutoxín
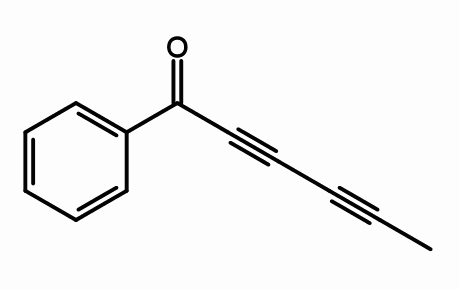 Štruktúra. Podľa Giorgiogp2 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0) alebo gfdl (http: // www.GNU.Org/copyleft/fdl.html)], z Wikimedia Commons
Štruktúra. Podľa Giorgiogp2 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0) alebo gfdl (http: // www.GNU.Org/copyleft/fdl.html)], z Wikimedia Commons Z molekulárnej štruktúry cikutoxínu, kde sú trojité väzby? Ak sú dvojité väzby ploché, ako sú viditeľné správne, a jednoduché väzby sú tetraedralmi, ako na koncoch, trojice sú lineárne a sú na svahu (\).
Táto zlúčenina pozostáva z neurotoxínu, ktorý sa nachádza hlavne vo vodnej liečivej rastline.
Capillina
 Štruktúra Capillina. Autor: Klever [CC0], z Wikimedia Commons
Štruktúra Capillina. Autor: Klever [CC0], z Wikimedia Commons Je to alkíny prítomné v éterickom oleji rastlín Artemis, ktorý sa používa ako protiplesňové činidlo. Je možné pozorovať dve trojité po sebe idúce odkazy, presnejšie konjugované.
Čo to znamená? Že trojité väzby rezonujú pozdĺž celého uhlíkového reťazca a zahŕňa, že dvojitá väzba C = o je otvorená C-O-.
Pargilín
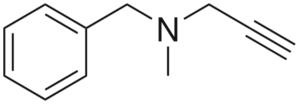 Štruktúra pargilínu
Štruktúra pargilínu Je to Alty s antihypertenzívnou aktivitou. Analýza jej štruktúry v častiach je: skupina Benchilo, vľavo, terciárny amín uprostred a pravá zákruta; to znamená skupinu vlastníctva terminálu.
Odkazy
- Francis a. Korytnačka. Organická chémia. Karboxylové kyseliny. (Šieste vydanie., Page 368-397). MC Graw Hill.
- Brennan, John. (10. marca 2018). Príklad alkínov. Vedecký. Prevzaté z: vedec.com
- Byju's. (2018). Trojnásobné puto v alkíne. Prevzaté z: Byjus.com
- Encyklopédia príkladov (2017). Alkíny. Obnovené z: príkladov.co
- Kevin a. Boudreaux. Alkíny. Prevzaté z: Angelo.Edu
- Robert C. Neuman, Jr. Alkény a alkynes. [PDF]. Prevzaté z: chem.Ucr.Edu

