Všeobecné aspekty, funkcie a príklady
- 4669
- 1000
- Alfréd Blaho
On Amosterizmus o Alostrická regulácia je definovaná ako proces inhibície alebo aktivácie enzýmu sprostredkovaného regulačnou molekulou odlišnou od jeho substrátu a pôsobí v špecifickom mieste jeho štruktúry, líši sa od aktívneho miesta toho istého.
Termín „výlučný“ alebo „aterizmus“ pochádza z gréckych koreňov “allos ", čo znamená „iná“ a „Stereós“, čo znamená „formu“ alebo „miesto“; Doslova sa prekladá ako „iný priestor“, „iné miesto“ alebo „iná štruktúra“.
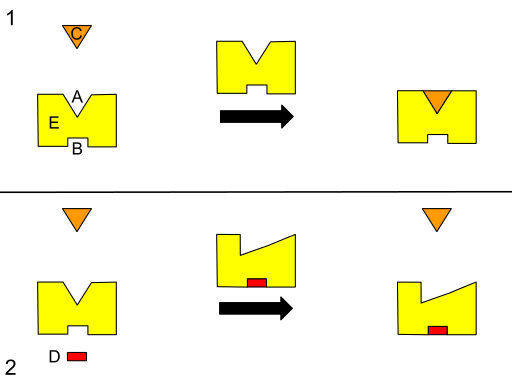
 Grafická schéma Atosterickej regulácie. A) aktívna stránka. B) výlučné miesto. C) substrát. D) inhibítor. E) enzým. (Zdroj: Isaac Webb [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons)
Grafická schéma Atosterickej regulácie. A) aktívna stránka. B) výlučné miesto. C) substrát. D) inhibítor. E) enzým. (Zdroj: Isaac Webb [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons) Niektorí autori opisujú aosterizmus ako proces, pomocou ktorého sú vzdialené miesta v systéme (napríklad štruktúra enzýmu) energeticky spojené tak, aby vytvorili funkčnú reakciu, a preto možno predpokladať, že zmena v oblasti môže ovplyvniť akékoľvek iné iné v rovnakom.
Tento typ regulácie je typický pre enzýmy, ktoré sa podieľajú na viacerých známych biologických procesoch, ako je transdukcia signálu, metabolizmus (anabolizmus a katabolizmus), regulácia genetickej expresie, okrem iného.
Prvé predstavy o aosterizme a ich účasti na kontrole bunkového metabolizmu boli predpokladané v 60. rokoch 20. storočia. Monod, f. Jacob a J. Changex, pri štúdiu biosyntetických trás rôznych aminokyselín, ktoré boli inhibované po akumulácii konečných produktov.
Aj keď prvá publikácia v tomto ohľade súvisela s genetickou reguláciou, o chvíľu neskôr Monod, Wyman a Changelux rozšírili koncepciu aosteralizmu na proteíny s enzymatickou aktivitou a navrhli model založený na multimérnych proteínoch, hlavne podporovaných interakciami medzi podjednotkami, keď akékoľvek akékoľvek podjednotky z nich sa pripojil k efektoru.
Môže vám slúžiť: Guanina: Charakteristiky, štruktúra, školenie a funkcieMnohé z nasledujúcich konceptov mali svoj základ v teórii „indukovaného prispôsobenia“, ktorú zaviedol Koshland pred niekoľkými rokmi pred niekoľkými rokmi.
[TOC]
Všeobecné vlastnosti
Všeobecne platí, že všetky enzýmy majú pre ligandovú úniu dve rôzne miesta: jedno je známe ako aktívne miesto, ktoré sa spája s molekulami, ktoré fungujú ako substrát (zodpovedné za biologickú aktivitu enzýmu), a druhý je druhý, ktorý je známy ako teosteric stránka, ktorá je špecifická pre iné metabolity.
Tieto „ďalšie metabolity“ sa nazývajú astherérne efektory a môžu mať pozitívne alebo negatívne účinky na rýchlosť reakcií katalyzovaných enzýmami alebo v afinite, s ktorou sa spájajú so svojimi substrátmi v aktívnom mieste.
Zvyčajne spojenie efektora na AL, enzýmové miesto spôsobuje účinok na iné miesto štruktúry, upravuje jej aktivitu alebo funkčný výkon.
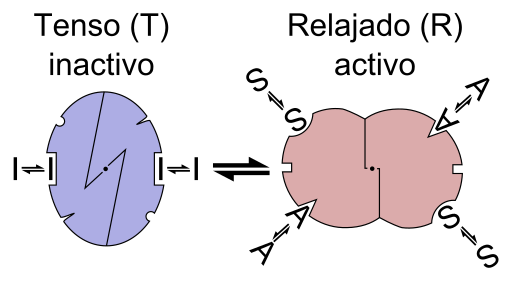 Grafická schéma reakcie enzýmu alosterica (Zdroj: súbor: enzýmová aloster.PNG: File: Enzým ALLOSTERY.PNG: ALLOSTERY.PNG: Nicolas Le Novere (Talk).Lenov vo vnútri.WikipediaDerivatívne dielo: Timvickers (Talk) Derivative Work: Retama (Talk) Derivát Work: KES47 [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Via Wikimedia Commons)
Grafická schéma reakcie enzýmu alosterica (Zdroj: súbor: enzýmová aloster.PNG: File: Enzým ALLOSTERY.PNG: ALLOSTERY.PNG: Nicolas Le Novere (Talk).Lenov vo vnútri.WikipediaDerivatívne dielo: Timvickers (Talk) Derivative Work: Retama (Talk) Derivát Work: KES47 [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Via Wikimedia Commons) Inými slovami, spojenie alestro efektora k jeho špecifickému miesta v štruktúre enzýmu spôsobuje zmenu molekulárnej geometrie enzýmu, ktorá je známa ako prechod na ateroster, to znamená, že je to udalosť, ktorá sa prenáša v celej makromolekule, modifikovanie jej správania.
Volírizmus môže byť homotropný alebo heterotropný. Proces homotropného alostroického regulácie je definovaný ako proces, v ktorom rovnaký substrát enzýmu pôsobí ako jeho alestický regulátor, to znamená, že aterický efektor je rovnaký substrát; Je tiež známy ako typ družstva.
Proces heterotropného regulácie sa na druhej strane týka regulácie aktivity enzýmu sprostredkovaného molekulou alebo efektorom teosterickej, ktorá sa líši od jeho substrátu a môže mať tiež pozitívne alebo negatívne účinky na aktivitu enzýmu.
Môže vám slúžiť: Apthénia Cordifolia: Charakteristiky, biotop, vlastnosti, kultiváciaFunkcia
Volínizmus, spolu s reguláciou genetickej expresie, translácie a degradácie proteínov, je jedným zo základných mechanizmov pre reguláciu veľkého počtu organických procesov, ktoré sú nevyhnutné na udržanie homeostázy a pre prežitie všetkých živých, jednobunkových alebo mnohardelých bytosť.
Toostatálna regulácia alebo aterizmus dáva živým organizmom schopnosť reagovať s veľkou citlivosťou na zmeny v koncentrácii regulačných ligandov, ako aj koncentráciu pôvodných rytmických javov na bunkovej úrovni.
Pretože energetické a metabolické substráty sú v bunke konečné, aterizmus umožňuje v metabolickom poli mierne využívanie zdrojov, vyhýbanie sa zbytočným cyklom a plytvaniu energie na nadmerné spracovanie substrátov v podmienkach hojnosti alebo nedostatku.
Podobne je tento regulačný mechanizmus veľmi dôležitý pre procesy bunkovej signalizácie, v ktorých je zapojených mnoho konformačných zmien, ktoré sú vyvolané spojením rôznych ligandov na špecifických miestach príslušných receptorov.
Príklady aterizmu
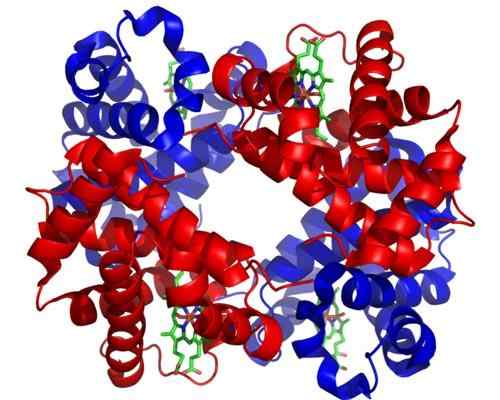 Hemoglobín. Prevzaté a upravené z: Zephyris v anglickom jazyku Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]].
Hemoglobín. Prevzaté a upravené z: Zephyris v anglickom jazyku Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Aj keď existujú tisíce príkladov toterizmu alebo regulácie v prírode, niektoré boli výraznejšie ako iné. To je prípad hemoglobínu, ktorý bol jedným z prvých proteínov opísaných v hĺbke v štrukturálnom aspekte.
Hemoglobín je veľmi dôležitý proteín pre mnoho zvierat, pretože je zodpovedný za transport kyslíka krvou z pľúc do tkanív. Tento proteín predstavuje zároveň homotropnú a heterotropnú až poterickú reguláciu.
Môže vám slúžiť: slaciacionizmus: charakteristiky, dôkazy a príkladyHomotropný aosterizmus hemoglobínu súvisí s spojením kyslíkovej molekuly s jednou z podjednotiek, ktoré ju skladajú priamo, ovplyvňuje afinitu, s ktorou je podjednotka susediaci s inou molekulou kyslíka viazala sa, čím sa zvyšuje (regulácia pozitívnej alebo kooperativizmu).
Heterotropický až heterotropický
Na druhej strane heterotropný aosterizmus súvisí s účinkami pH a prítomnosti 2,3-difoglyceleratera na spojenie kyslíka s podjednotkami tohto enzýmu, čo ho inhibuje.
Transcarbamiláza alebo aspartát Atcasa, ktorý sa podieľa na trase syntézy pyrimidínu, je tiež jedným z „klasických“ príkladov výlučnej regulácie. Tento enzým, ktorý má 12 podjednotiek, z ktorých 6 je katalyticky aktívnych a 6 sú regulátormi, je heterotropicky inhibovaný konečným produktom trasy, ktorá hlava, cytidininatrifosfát (CTP).
Laktózový operón A. coli
Ovocie prvých myšlienok Monoda, Jacoba a Changeauxa bol článok publikovaný Jacobom a Monodom v súvislosti s laktózou laktózy laktózy Escherichia coliJo, čo je jeden z typických príkladov regulácie heterotropných až genetickej úrovne.
Toostatálna regulácia tohto systému nesúvisí so schopnosťou previesť substrát na produkt, ale s afinitou spojenia proteínu k prevádzkovej oblasti DNA.
Odkazy
- Changex, J. P., & Edelstein, s. J. (2005). Alosterické mechanizmy prenosu signálu. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, G. (1990). Alosterická regulácia, družstvo a biochemické oscilácie. Biofyzikálna chémia, 37 (1-3), 341-353.
- Jiao, w., & Parker a. J. (2012). Pomocou komplikácie výpočtových a experimentálnych techník na pochopenie molekulárneho základu pre proteínovú aloster. V pokrokoch v proteínovej chémii a štrukturálnej biológii (zv. 87, pp. 391-413). Akademická tlač.
- Kern, D., & Zuiderweg a. R. (2003). Úloha dynamiky v alosterickej regulácii. Súčasné stanovisko v štrukturálnej biológii, 13 (6), 748-757.
- Laskowski, r. Do., Gerick, f., & Thornton, J. M. (2009). Štrukturálny základ alosterickej regulácie proteínov. Febs Letters, 583 (11), 1692-1698.
- Mathews, C. Klimatizovať., Van Holde, K. A., & Ahern, K. G. (2000). Biochemistry, ed. San Francisco, Kalifornia.
- « Štruktúra uhlíkových nanorúrok, vlastnosti, aplikácie, toxicita
- Adaptívny proces žiarenia, typy a príklady »

