Etylalkohol štruktúra, vlastnosti, použitia, získanie
- 2151
- 417
- Mgr. Pravoslav Mokroš
On Etylalkohol alebo etanol Je to organická zlúčenina, ktorej vzorec je C2H5Oh alebo ch3Chvály2Oh, prezentuje sa ako bezfarebná tekutina. Toto je druhý najjednoduchší primárny alkohol zo všetkých po metanole. Je veľmi rozpustný vo vode a v mnohých organických rozpúšťadlách, čo umožnilo vývoj mnohých jej aplikácií.
Tento alkohol sa používa ako antiseptický a dezinfekčný, okrem použitia pri syntéze liekov a iných organických chemikálií. Používa sa tiež ako palivo v ohrievači, žiarovkách a v kombinácii s benzínom v motorových vozidlách.

Fermentácia cukru na výrobu etanolu je jednou z prvých chemických reakcií, ktoré sa primitívny človek naučil. V Číne bola nájdená 9000 -ročná keramika.
Ale fermentácia cukrov priniesla iba veľmi nízky roztok etanolu koncentrácie, a preto bolo potrebné naučiť sa destilačné techniky na odstránenie vody a koncentrovanie alkoholu. Grécki alchymisti, ktorí pracovali v Alexandrii v 1. storočí.C., Už vedeli a používali destiláciu.
Existujú však syntetické trasy, ktoré umožňujú získať úplne čistý etanol na základe etylénu, ktorý je destilovaný z oleja. Preto je olej nepriamym zdrojom etanolu. Týmto spôsobom sa získa etanol alebo absolútny alkohol.
[TOC]
Štruktúra etylalkoholu
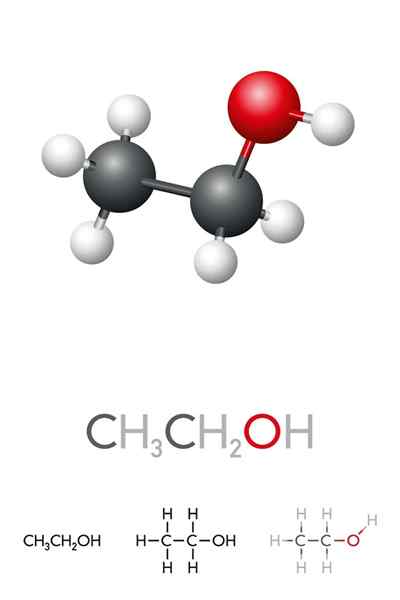
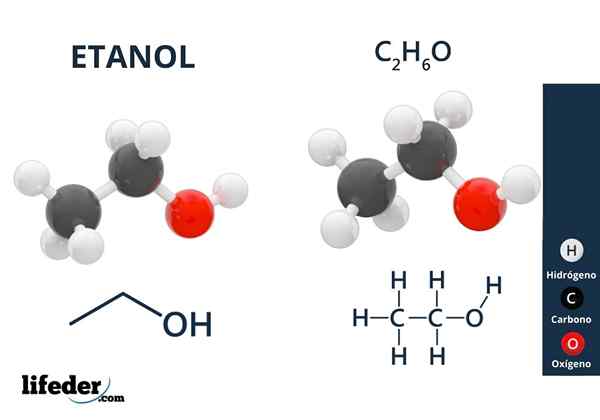
Na vynikajúcom obraze máme molekulárnu štruktúru etanolu, Cho3-Chvály2-Oh, zastúpený modelom s úplným priestorom. Je to skôr polárny molekulárny, pretože skupina OH priťahuje elektronickú hustotu voči sebe uhlíkovej kostry, s ktorou je prepojená.
Výsledkom je, že molekuly etylalkohole3Chvály2Oh-ohch2Chvály3. Preto má tento alkohol vysoký bod varu v porovnaní s inými organickými rozpúšťadlami alebo tekutkami.
Vlastnosti
Fyzický vzhľad
Bezfarebná tekutina.
Molárna hmota
46.069 g/mol
Vôňa
Mäkká vôňa a podobné vínu.
Príchuť
Popáliť.
Hustota
0.789 g/cm3 pri 20 ° C
Bod topenia
- 114,14 ° C
Bod varu
78,24 ° C
Rozpustnosť
1 · 106 mg/l. To znamená, že je prakticky miešateľný vo všetkých rozmeroch.
Misabilita s organickými rozpúšťadlami
Etanol je miešateľný s kyselinou octovou, acetónom, benzénom, tetrachloridom uhlíkom, chloroformom, dityl éterom, etylénglykol, glycerol, pyridín a toluén. Je tiež miešateľný s ľahkými alifatickými uhľovodíkmi, ako sú Pentano a Hexano.
Koeficient priečneho októbra/vody
Log p = - 0.31
Tlak vodnej pary
59.3 mm Hg pri 25 ° C. Preto zamietol vnímateľné množstvo výparov.
Môže vám slúžiť: chlorid bária (BACL2)Hustota
1.59 vo vzdušnom vzťahu prijaté ako jednotka (1)
zapaľovač
13 ° C
Teplota
363 ° C
Spaľovacie teplo
1336.8 kJ/mol A 25 ° C
Spaľovanie
Etanol je prchavá tekutina, ktorá horí modrým plameňom, bez dymu, a to je prakticky neviditeľné pre prirodzené svetlo.
Špecifické teplo
0.618 limet/g pri 23 ° C
Hrebeň
1.2 MPa · S pri 20 ° C
Index lomu ηd
1.3611
Použitie etylalkoholu
 Jeden z najbežnejších spôsobov alkoholu je ako antiseptický
Jeden z najbežnejších spôsobov alkoholu je ako antiseptický Lekárske použitie
Antiseptický
Etanol sa používa ako antiseptikum, pretože má smrteľný účinok proti baktériám a húb. Je schopný zmeniť štruktúru svojich plazmových membrán, ktoré spôsobujú jeho deštrukciu tokmi osmotických vody, ktoré sú stanovené.
Podobne môže etanol zničiť mnoho druhov vírusov. V súčasnosti sa odporúča používanie gélov, ktoré obsahujú alkohol na dezinfekciu ich rúk a zníženie nákazy s koronavírusom. Etanol sa tiež používa pri dezinfekcii povrchových menších rán.
Rozpúšťadlo drogy
Mnoho liekov je vo vode málo rozpustných, pričom na zvýšenie rozpustnosti využíva etanol. Niektoré struky na kašeľ a výplaty úst majú etanolový kontext až 25%.
Liečba bolesti
Etanol sa používa na terapeutickú lýzu nervov alebo ganglií na úľavu chronickej nevyliečiteľnej bolesti, prítomnej pri nefunkčnom rakovine alebo v trigeminálnej neuralgii.
Liečba symptomatických cystov štítnej žľazy
Perkutánne injekcie etanolu sa používajú pri liečbe cystov štítnej žľazy, čo je jednoduchý postup, ktorý by sa mohol vyhnúť komplikáciám chirurgického zákroku.
Sedatívna činnosť
Etanol sa občas podáva intravenózne pre predoperačnú a pooperačnú sedáciu, u pacientov, ktorým nie sú použiteľné iné opatrenia.
Antidotum
Etanol sa používa systémový na liečbu otravy metanolom alebo etylénglykolom.
Glaukóm
Etanol sa používa na zníženie intraokulárneho tlaku u pacientov s glaukómom.
Palivo
Spojené štáty spolu s Brazíliou spotrebúvajú 90% etanolu používaných ako palivo v automobiloch. Spojené štáty sú najväčším výrobcom kukurice na svete, takže používa kukuricu ako zdroj etanolu ako paliva.
Vláda dotovala pestovateľov kukurice, ktorá v rokoch 1979 až 1986 zvýšila výrobu palivového etanolu 20 miliónov galónov ročne na 750 miliónov galónov.
Cukrová trstina je hlavným zdrojom etanolu v Brazílii na použitie ako palivo. V roku 1943, kvôli druhej svetovej vojne.
Môže vám slúžiť: DeuteriumOd roku 1976 sa používajú ako palivo v zmesiach etanolu a benzínu, ktorých obsah etanolu sa pohybuje medzi 10 a 25 %, v závislosti od výroby cukrovej trstiny.
Rekreačné použitie
Etanol je prítomný v mnohých nápojoch používaných na sociálnych stretnutiach a dokonca aj počas obeda a rodinnej večery.
Počiatočné pôsobenie alkoholu na dezinhibovanie sociálneho správania osoby vytvára príjemné a uľahčujúce prostredie interakcie medzi ľuďmi. Prebytočný etanol však môže odpaľovať toxické a nežiaduce účinky na osobné zdravie a v harmónii medzi stretnutiami alebo udalosťami.
Osobná starostlivosť
Etanol je prítomný v mnohých kozmetických a kozmetických výrobkoch. Okrem toho, vďaka svojej adstringentnej činnosti sa používa pri čistení pokožky, eliminácii tuku a špinavých zostáva, že voda a mydlo to nerobia. Je tiež súčasťou prípravy mnohých pleťov a parfumov.
Jedlo
Podstata vanilky, príchuť použitia v koláčoch a koláčoch, sa rozpustí v zmesi etanolu a vody. Cukrovinky, ktoré sú plné určitých alkoholických nápojov, sa predávajú. Alkohol sa tiež používa ako chuť niektorých sladkostí.
Získanie etylalkoholu
Etanol sa získava hlavne fermentáciou cukru a hydratáciou etylénu, ktorý sa nacvičuje na jeho produkciu z oxidu uhličitého, lipidov a celulózy.
Fermentácia
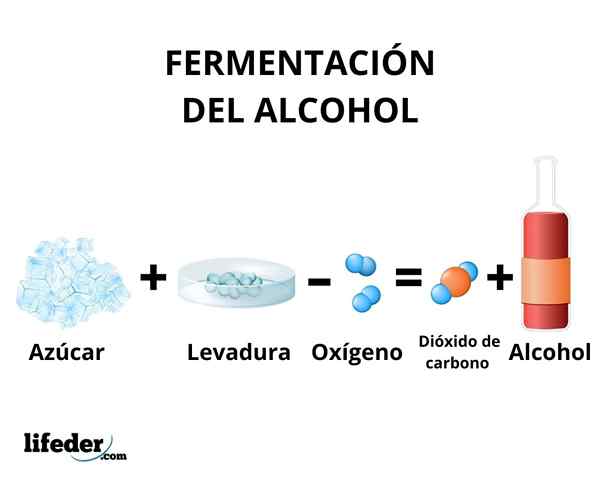
V procese fermentácie sa transformácia uhľohydrátov v etanole vyskytuje pôsobením enzýmov prítomných v kvasinkách. Hlavne sa ako surovina používa.
Enzýmy glykolýzy niektorých druhov kvasiniek, napríklad Sacharomyces cerevisiae, Sú schopní konať na glukózové a sacharózové cukry, aby produkovali etanol. Koncentrácia produkovaného etanolu je obmedzená citlivosťou kvasiniek na etanol.
V každom prípade koncentrácia etanolu produkovaného fermentáciou nepresahuje 18%. Je potrebné koncentrovať roztok etanolu pomocou jednoduchej destilácie. Prostredníctvom tejto metódy sa získa roztok etanolu s koncentráciou okolo 95%.
Nakoniec sa používa frakcionovaná destilácia a 95% dehydratácia alkoholu pre absolútnu produkciu alkoholu. Etanol produkovaný fermentáciou sa používa v medicíne a je vyhradený ako palivo, ktoré dopĺňa benzín.
Hydratácia etylénu
V tomto procese sa etylén zmieša s vysokými teplotami s deionizovanou parou pri vysokých teplotách, medzi 250 a 300 ° C a pod tlakom 6.8 MPA. Konverzia etylénu na etanol sa katalyzuje kyselinou fosforečnej umiestnenou na silici alebo dieroms pozemné lôžko.
Môže vám slúžiť: Mechanické vlastnosti kovovReakcia o hydratácii etylénu sa môže schematizovať takto:
C2H4 + H2O → ch3Chvály2Oh
Časť kyseliny fosforečnej je ťahaná vodnou parou a mala by sa neutralizovať zriedeným hydroxidom sodným. Koncentrácia etanolu získaná hydratáciou etylénu je nízka, s hodnotou medzi 10 a 25%.
Potom je roztok etanolu koncentrovaný destiláciou a získa 95% roztok etanolu, ktorý sa môže vykonať 100% frakčnou destiláciou a dehydratáciou.
Iné metódy
Z alternatívnych metód na výrobu etanolu máme používanie oxidu uhličitého, lipidov a celulózy. Použitie celulózy je sľubnejšie, pretože materiály ako drevo, slama, odpadové papiere atď., ako zdroj celulózovej suroviny. Celulóza je glukózový polymér a môže sa použiť ako zdroj tohto uhľohydrátu.
Toxicita a riziká
 Domáce alkoholové lode sa zvyčajne nachádzajú v koncentrácii 70%-90%
Domáce alkoholové lode sa zvyčajne nachádzajú v koncentrácii 70%-90% Vdýchnutie
Vysoké koncentrácie etanolovej pary môžu spôsobiť ospalosť, podráždenie očí a horný dýchací trakt, ktoré sa prejavujú kašľom a bolesťou hlavy.
Priamy kontakt s pokožkou a očami
Kontakt kože môže spôsobiť suchosť a chronické, podráždenie a dermatitída. Medzitým očný kontakt vedie k podráždeniu, začervenaniu, bolesti a pocitu pálenia.
Požitie
Vytvára pocit horiaceho a spočiatku má stimulačný a príjemný účinok v dôsledku vyprodukovanej dezinhibície. Ale keď príjem alkoholu pokračuje, existuje nervová depresia, bolesti hlavy, rozmazané videnie, ospalosť a bezvedomie.
Chronické účinky
Etanol ovplyvňuje centrálny nervový systém a horné dýchacie ciest. Okrem toho poškodenie pečene spôsobené požitím etanolu môže viesť k cirhóze a následne smrti.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Etanol. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Etanol. Pubchem Comunund Zhrnutie pre CID 702. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Etanol. (2011). História etanolu - od alkoholu po palivo. Získané z: Etanolhistory.com
- Redaktori Enyclopaedia Britannica. (2020). Etanol. Získané z: Britannica.com
- Vyhotovený. (15. októbra 2000). Bezpečnostný list (MSD) etylalkohol. [PDF]. Získané z: iio.End.UABC.mx
- Byju's. (2020). Použitie metanolu a etanolu. Získané z: Byjus.com
- HelMestine, Anne Marie, PH.D. (25. augusta 2020). Rozdiel medzi alkoholom a etanolom. Zotavené z: Thoughtco.com

