Acetonitril (C2H3N)
- 4880
- 421
- MUDr. Žigmund Boška
Čo je acetonitril?
On acetonitril Je látkou organického pôvodu zloženej iba z uhlíka, vodíka a dusíka. Tento chemický druh patrí do skupiny nitrilov, pričom acetonitril je najjednoduchšou štruktúrou medzi organickým typom.
Nitrily sú triedou chemických zlúčenín, ktorých štruktúra je tvorená skupinou kyanidov (CN-) a radikálny reťazec (-R). Tieto prvky sú znázornené prostredníctvom nasledujúceho všeobecného vzorca: r-c≡n.
Je známe, že táto látka je primárne vznikajúca počas výroby iného druhu nazývaného Acrilonitril (ďalší jednoduchý nitril, molekulárneho vzorca C3H3N, ktorý sa používa pri vypracovaní výrobkov v textilnom priemysle) ako vedľajší produkt toho istého.
Okrem toho sa acetonitril považuje za rozpúšťadlo s vlastnosťami strednej polarity, a preto sa používa pomerne pravidelne pri analýze RP-HPLC (akronym v angličtine pre vysoko účinnú kvapalinovú chromatografiu reverznej fázy).
Štruktúra
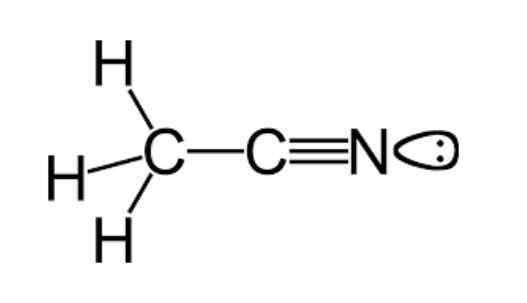
Ako už bolo spomenuté, acetonitril patrí do funkčnej skupiny nitrilov, ktorá má molekulárny vzorec, ktorý je bežne znázornený ako C2H3N, ktorý je možné pozorovať v štrukturálnom vzorci, ktorý je uvedený v hornom obrázku.
Tento obrázok zobrazuje triedu laloku pripojeného k atómu dusíka, ktorý predstavuje pár chýbajúcich elektrónov, ktoré má tento atóm, a ktoré mu dodávajú veľkú časť vlastností reaktivity a stability, ktoré sú charakteristické.
Týmto spôsobom tento druh prejavuje veľmi konkrétne správanie kvôli jeho štrukturálnemu usporiadaniu, ktoré sa premieta do slabosti prijímania vodíkových väzieb a malej schopnosti darovať elektróny.
Môže vám slúžiť: arzén: História, štruktúra, vlastnosti, použitiaPodobne, táto látka pochádza po prvýkrát v druhej polovici 40. rokov 20. storočia, ktorú vyrába vedec menom Jean-Baptiste Dumas, ktorého národnosť bola francúzština.
Štrukturálna konformácia tejto látky umožňuje túto charakteristiku rozpúšťadla organickej povahy.
Táto vlastnosť zase umožňuje zmiešanie acetonitrilu, okrem série ďalších rozpúšťadiel organického pôvodu, s výnimkou uhľovodíkov alebo nasýtených uhľovodíkových druhov.
Vlastnosti acetonitril
Táto zlúčenina má sériu vlastností, ktoré ju odlišujú od ostatných od tej istej triedy, ktoré sú uvedené nižšie:
- Je v stave agregácie kvapaliny v štandardných podmienkach tlaku a teploty (1 atm a 25 ° C).
- Jeho molekulárna konfigurácia jej dodáva molárnu hmotnosť alebo molekulovú hmotnosť približne 41 g/mol.
- Považuje sa za nitril, ktorý má najjednoduchšiu štruktúru, medzi organickými typmi.
- Jeho optické vlastnosti mu umožňujú bezfarebné v tejto kvapalnej fáze a limitné charakteristiky, okrem aromatického zápachu.
- Má zápalový bod okolo 2 ° C, čo zodpovedá 35,6 ° F alebo 275,1 K.
- Predstavuje bod varu v rozmedzí 81,3 až 82,1 ° C, čo je hustota približne 0,786 g/cm3 a bod topenia medzi -46 až -44 ° C.
- Je menej hustá ako voda, ale je miešateľná s tým a s rôznymi organickými rozpúšťadlami.
- Vykazuje okrem dipólového momentu približne 3,92 d dielektrickú konštantu 38,8.
- Je schopný rozpustiť širokú škálu látok iónového pôvodu a nepolárnej povahy.
- V analýze HPLC sa používa ako mobilná fáza, ktorá predstavuje vysoké horľavosti vlastností.
Použitie/aplikácie
Medzi veľké množstvo aplikácií, ktoré má acetonitril, je možné spočítať:
- Podobne iné druhy nitrilov to môže prejsť metabolizačným procesom v mikrozómoch (vezikulárne prvky, ktoré sú súčasťou pečene), najmä v tomto orgáne, aby vznikli kyselina kyanridová.
- Používa sa veľmi zovšeobecneným spôsobom ako mobilná fáza v type analýzy nazývanej vysoko účinná inverzná fáza kvapalinová chromatografia (RP-HPLC); To znamená, že ako eluentná látka, ktorá má vysokú stabilitu, veľká eluent a znížená viskozita.
- V prípade aplikácií priemyselného rozsahu sa táto chemická zlúčenina používa v rafinériách ropy ako rozpúšťadlo v určitých procesoch, ako je napríklad čistenie alkene s názvom butadieno.
- Používa sa tiež ako ligand (chemické druhy, ktorý je kombinovaný s atómom kovového prvku, považovaný za centrálny v danej molekule, za vzniku koordinačnej zlúčeniny alebo komplexu) vo veľkom počte nitrilových zlúčenín s kovmi prechodnej skupiny.
- Podobne sa používa v syntéze organického typu pre veľké množstvo chemikálií tak výhodných ako kyselina a-naftalén, tiamín alebo acetamidín hydrochlorid.
Riziká
Riziká spojené s expozíciou acetonitrilu sú rôzne. Medzi nimi patrí znížená toxicita, keď je expozícia na znížené časové obdobie a v nízkych množstvách, ktorá sa metabolizuje na výrobu kyseliny cyanhydrovej.
Podobne existovali prípady ľudí, ktorí sa otrávili týmto chemickým druhom a boli otrávení kyanidom prítomným v molekule po tom, čo boli v kontakte s acetonitrilom v rôznych stupňoch (pri vdýchnutí, požití alebo absorbovaní kožou).
Môže vám slúžiť: olej alebo benzín éter: vzorec, štruktúra, použitieZ tohto dôvodu sú dôsledky jeho toxicity oneskorené, pretože telo túto látku ľahko nemetalizuje v kyanide, pretože na to sú potrebné dve až dvanásť hodín.
Acetonitril sa však ľahko vstrebáva do oblasti pľúc a gastrointestinálneho traktu. Následne sa jej distribúcia dochádza v celom organizme, ktorý sa deje u ľudí a dokonca aj u zvierat a dosahuje obličky a slezinu.
Na druhej strane, okrem rizík horľavosti, ktorú predstavuje, je acetonitril predchodcom takých toxických látok, ako je cyanhydrická alebo formaldehydová kyselina. Dokonca aj jeho použitie vo výrobkoch patriacich do kozmetickej oblasti v tzv. Európskom ekonomickom priestore v roku 2000.

