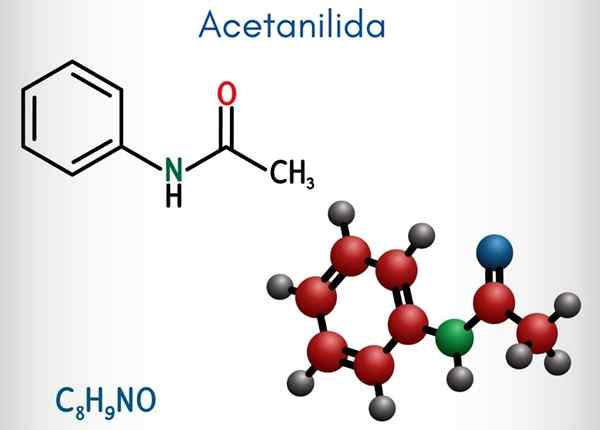
Acetanylid (C8H9No)
- 3344
- 440
- JUDr. Rudolf Čapkovič
Čo je acetanylid?
Ten acetanylid (C8H9Nie) Je to aromatický amid, ktorý prijíma niekoľko ďalších mien: N-acetrarilamín, N-Fenilacetamid a AtHanil. Je prezentovaný ako pevná toaleta vo forme vločiek, jeho chemická povaha je amida, a preto môže pri reagovaní so silnými redukčnými činidlami tvoriť horľavé plyny.
Okrem toho je to slabá základňa, ktorá je schopná reagovať s dehydratačnými činidlami ako P2Ani5 Na pôvodný nitril. Zistilo sa, že acetanylid mal analgetický a antipyretický účinok a v roku 1886 ho použil s názvom antifebrin. Cahn a P. Hrebeň.
V roku 1899 bola na trh zavedená kyselina acetylsalicylová (aspirín), ktorý mal rovnaké terapeutické účinky ako acetanilid. Ak použitie acetanylidu súvisí s výskytom cyanózy u pacientov - dôsledkom methemoglobinémie vyvolanej acetanylidom - jeho použitie bolo vyradené.
Následne sa zistilo, že analgetický a antipyretický účinok acetanylidu býval v metabolite tohto takzvaného paracetamolu (acetoaminofén), ktorý nemal jeho toxické účinky, ako navrhli Axelrod a Brodie.
Chemická štruktúra

Na hornom obrázku je zastúpená chemická štruktúra acetanylidu. Vpravo je hexagonálny aromatický kruh benzénu (so bodkovanými čiarami) a ľavica je dôvod, prečo zlúčenina pozostáva z aromatickej amida: acetamidovej skupiny (Hncoch3).
Skupina acetamidu dáva benzénovému kruhu väčší polárny charakter; To znamená, vytvorte dipólový moment v molekule atetanylidu.
Pretože? Pretože dusík je viac elektronegatívny ako ktorýkoľvek z atómov uhlíka kruhu a je tiež spojený s acylovou skupinou, ktorej atóm alebo tiež priťahuje elektronickú hustotu.
Môže vám slúžiť: uretán: štruktúra, vlastnosti, získanie, použitieNa druhej strane takmer celá molekulárna štruktúra acetanylidu spočíva na tej istej rovine v dôsledku hybridizácie SP2 atómov, ktoré ho skladajú.
Existuje výnimka spojená s výnimkami skupiny -ch3, ktorých atómy vodíka tvoria vrcholy tetraedronu (biele gule ľavého konca opúšťajú lietadlo).
Rezonančné štruktúry a intermolekulárne interakcie
Osamelý krútiaci moment bez zdieľania atómu N cirkuluje cez π systém aromatického kruhu, ktorý pochádza z niekoľkých rezonančných štruktúr. Jedna z týchto štruktúr však končí negatívnym zaťažením atómu O (viac elektronegatívne) a pozitívnym zaťažením atómu n.
Existujú teda rezonančné štruktúry, kde sa v kruhu pohybuje negatívne zaťaženie a ďalšie, kde sa nachádza v atóme alebo. V dôsledku tejto „elektronickej asymetrie“-ktorá pochádza z ruky molekulárnej asymetrie-, acetanylid interaguje intermolekulárne dipólovými dippolami.
Interakcie vodíkových mostíkov (N-H-O-…) medzi dvoma molekulami acetanylidu sú však v skutočnosti prevládajúcou silou v jeho kryštalickej štruktúre.
Týmto spôsobom sa acetanylidové kryštály pozostávajú z ortorrhrombických jednotkových buniek ôsmich molekúl orientovaných s formami „plochých pásky“ pomocou ich vodíkových mostov.
Vyššie uvedené je možné vizualizovať, ak je molekula acetanylidu umiestnená na druhej strane, paralelne. Takže, rovnako ako skupiny hncoch3 Prekrývajú sa pokojne, tvoria mosty vodíka.
Okrem toho, medzi týmito dvoma molekulami môže byť tiež „ukradnutá“ tretinu, ale s aromatickým krúžkom smerujúcim na opačnú stranu.
Môže vám slúžiť: bromotimol modráChemické vlastnosti acetanylid
 Príťažlivý vzhľad
Príťažlivý vzhľad Molekulová hmotnosť
135,166 g/mol.
Chemický opis
Biela alebo šedá pevná látka. Vytvorte jasne biele vločky alebo kryštalický biely prášok.
Vôňa
Záchod.
Príchuť
Mierne pikantný.
Bod varu
304 ° C až 760 mmHg (579 ° F pri 760 mmHg).
Bod topenia
114,3 ° C (237,7 ° F).
Blesk alebo horľavosť
169 ° C (337 ° F). Meranie uskutočnené v otvorenom skle.
Hustota
1 219 mg/ml pri 15 ° C (1 219 mg/ml pri 59 ° F)
Hustota
4,65 s vzdušným vzťahom.
Tlak vodnej pary
1 mmHg pri 237 ° F, 1,22 x 10-3 mmHg pri 25 ° C, 2A pri 20 ° C.
Stabilita
Trpí chemickým zadkom pri vystavení ultrafialovému svetlu. Ako sa zmení štruktúra? Acetylová skupina tvorí nové odkazy v kruhu v orto pozíciách a pre. Okrem toho je stabilný vo vzduchu a nekompatibilný so silnými oxidačnými činidlami, žieravicami a alkalismi.
Volatilita
Značne prchavé pri 95 ° C.
Sebaprečanie
1004 ° F.
Rozklad
Pri zahrievaní sa rozkladá a emituje vysoko toxický dym.
pH
5 - 7 (10 g/l H2Alebo 25 ° C)
Rozpustnosť
- Vo vode: 6,93 × 103 mg/ml pri 25 ° C.
- 1 g rozpustnosť acetanylidu v rôznych kvapalinách: v 3,4 ml alkoholu, 20 ml vriacej vody, 3 ml metanolu, 4 ml acetónu, 0,6 ml vriaceho alkoholu, 3,7 ml chloroformu, 5 ml glierolu, 8 ml dioxan, 47 ml benzénu a 18 éter. Hydrát chlorácie zvyšuje rozpustnosť acetanilidu vo vode.
Syntéza
Je syntetizovaný reagovaním anhydridu acetanylidu. Táto reakcia sa objavuje v mnohých textoch organickej chémie (Vogel, 1959):
C6H5NH2 + (Ch3Co)2O => c6H5Nhcoch3 + Chvály3Kohútik
Môže vám slúžiť: Borax: História, štruktúra, vlastnosti, použitie, syntéza, rizikáŽiadosti
- Je to inhibítorové činidlo procesu rozkladu peroxidu vodíka (peroxid vodíka).
- Stabilizujte laky esteru celulózy.
- Zasahuje ako sprostredkovateľ pri zrýchlení výroby gumy. Podobne je sprostredkovateľom v syntéze niektorých farbív a gáforu.
- Pôsobí ako predchodca v syntéze penicilínu.
- Používa sa na výrobu 4-acetamidefonilbenzénu chloridu. Acetanylid reaguje s kyselinou chlórulfónovou (HSO3Cl), čím sa produkuje chlorid 4-aminosulfonilbenzénu. To reaguje s amónnym alebo primárnym organickým amínom za vzniku sulfonamidov.
- Experimentálne sa použil v devätnástom storočí pri vývoji fotografie.
- Acetanylid sa používa ako marker elektroosmotických tokov (EOF) v kapilárnej elektroforéze na štúdium súvislosti medzi liečivami a proteínmi.
- Nedávno sa 1- (co-fenoxialkiluracilo) spojil v inhibícii experimentov s inhibičnými experimentmi vírusu hepatitídy C. Acetanylid spája polohu 3 pyrimidínového kruhu.
- Experimentálne výsledky naznačujú zníženie replikácie vírusového genómu bez ohľadu na vírusový genotyp.
- Pred identifikáciou toxicity acetanylidu sa od roku 1886 použil ako analgetický a antipyretický. Následne (1891) sa použil pri liečbe chronickej a akútnej bronchitídy od Grüna.