Molárne absorbovanie
- 2678
- 342
- Václav Višňovský
Čo je molárna absorpcia?
Ten Molárne absorbovanie Je to chemická vlastnosť, ktorá naznačuje, koľko svetla dokáže absorbovať druh v roztoku. To znamená, že je to jednotka, ktorá meria schopnosť roztoku absorbovať svetlo.
Pretože svetlo pozostáva z fotónov s energiou (alebo vlnovými dĺžkami), v závislosti od druhu alebo zmiešanej zmesi, fotón sa môže absorbovať vo väčšej miere ako iný. Znamená, že svetlo sa absorbuje pri určitých vlnových dĺžkach charakteristických pre látku.
Hodnota molárnej absorbity je teda priamo úmerná stupňu absorpcie svetla na určitú vlnovú dĺžku. Ak druh absorbuje malé červené svetlo, jeho absorbujúca hodnota bude nízka. Ak dôjde k výraznej absorpcii červeného svetla, absorbita bude mať vysokú hodnotu.
Druh, ktorý absorbuje červené svetlo, bude odrážať zelenú farbu. Ak je zelená farba veľmi intenzívna a tmavá, znamená to, že existuje silná absorpcia červeného svetla.
Niektoré zelené odtiene však môžu byť spôsobené reflexmi rôznych rozsahov žltej a modrej, ktoré sú zmiešané a vnímané ako tyrkysová zelená, smaragd, sklo atď.
Molárna rovnica
Molárna absorbita je konštanta definovaná v matematickej expresii Lambertovho piva zákona a jednoducho poukazuje na to, koľko svetla absorbuje chemické druhy alebo zmes. Rovnica je:
A = εbc
Kde a je absorbancia roztoku na zvolenú vlnovú dĺžku λ, b je dĺžka bunky, kde je vzorka, ktorá sa má analyzovať koncentrácia absorpčného druhu a ε, molárne absorbovanie.
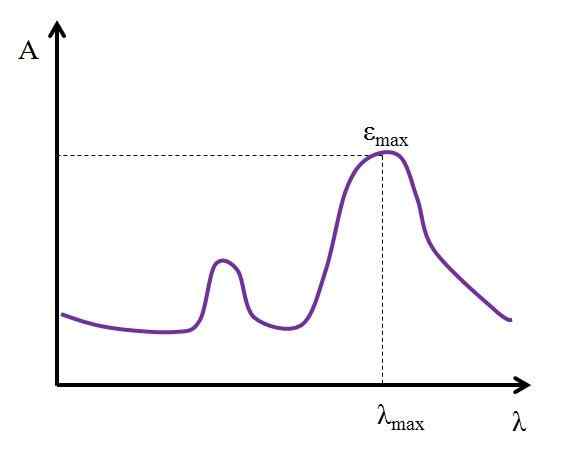
Môže vám slúžiť: AlquinosVzhľadom na λ, vyjadrené v nanometroch, hodnota ε zostáva konštantná. Ale zmenou hodnôt λ, to znamená meranie absorbancií so svetlami iných energií, ε zmeny, dosiahnutím minimálnej alebo maximálnej hodnoty.
Ak je známa jeho maximálna hodnota, εMaximálny, Je určená súčasne λMaximálny. To znamená, že svetlo, ktoré najviac absorbuje tento druh:
 Graf, kde sú znázornené maximálne hodnoty absorpcie svetla chemického druhu. Zdroj: Gabriel Bolívar
Graf, kde sú znázornené maximálne hodnoty absorpcie svetla chemického druhu. Zdroj: Gabriel Bolívar Jednotky
Aby sme poznali jednotky ε, musíme vedieť, že absorbancie sú bezrozmerné hodnoty, a preto sa musí vynásobiť násobenie jednotiek B a C.
Koncentrácia absorpčného druhu sa môže exprimovať buď v g/l alebo mol/l a B sa zvyčajne exprimuje v CM alebo M (pretože je to dĺžka bunky, ktorá prechádza svetlom lúča). Molarita sa rovná mol/l, takže C je tiež vyjadrená ako m.
Získa sa teda vynásobenie jednotiek B a C: m ∙ cm. Jednotky, ktoré ε musia opustiť hodnotu a sú jednotky, ktoré sa množia.
Vyčistenie u, jednoducho si získajte M-1∙ cm-1, ktoré je možné napísať aj ako: l ∙ mol-1∙ cm-1.
V skutočnosti používajte M jednotky-1∙ cm-1 alebo l ∙ mol-1∙ cm-1 urýchľuje výpočty na stanovenie molárnej absorbity. Zvyčajne sa však vyjadruje s M jednotkami2/mol alebo cm2/mol.
Pri vyjadrovaní týchto jednotiek sa musia niektoré konverzné faktory použiť na úpravu jednotiek B a C.
Ako vypočítať molárnu absorbita?
Priame povolenie
Molárna absorbita sa dá vypočítať priamo jej zúčtovaním v predchádzajúcej rovnici:
Môže vám slúžiť: kyseliny a základne v každodennom živote: reakcie, použitia, príkladyε = A/BC
Ak je známa koncentrácia absorpčného druhu, dĺžka bunky a čo je absorbancia získaná pri vlnovej dĺžke, je možné vypočítať ε. Tento spôsob výpočtu však poskytuje nepresnú a nespoľahlivú hodnotu.
Grafická metóda
Ak je dôkladne pozorovaná rovnica Lambert-Beerovho zákona, bude potrebné poznamenať, že pripomína rovnicu riadku (y = AX+B).
To znamená, že ak sú hodnoty osi A grafické. Tak by to bolo y, x bolo c a bolo by to rovnocenné εb.
Preto riadkový graf stačí na určenie sklonu, to znamená. Akonáhle sa to stane a dĺžka bunky, b, je ľahké vyčistiť hodnotu ε.
Na rozdiel od priameho vyčistenia, graf Vs. C vám umožňuje priemerné merania absorbancie a znížiť experimentálnu chybu a tiež prostredníctvom jediného bodu, ktorý môžu prejsť nekonečným rovným, takže priama vôľa nie je praktická.
Experimentálne chyby môžu tiež urobiť čiaru, ktoré neprechádzajú dvoma, tromi alebo viacerými bodmi, takže čiara získaná po použití minimálnej štvorcovej metódy sa skutočne používa (funkcia, ktorá je už začlenená do kalkulačiek).
To všetko za predpokladu vysokej linearity, a teda dodržiavania zákona Lamber-Beerovho zákona.
Vyriešené cvičenia
Cvičenie 1
Je známe, že roztok organickej zlúčeniny s koncentráciou 0.008739 m predstavoval absorbanciu 0.6346, merané pri λ = 500 nm a s bunkou 0.5 cm dlhá. Vypočítajte, čo je molárna absorpcia komplexu na uvedenú vlnovú dĺžku.
Môže vám slúžiť: nikel: História, vlastnosti, štruktúra, použitie, rizikáZ týchto údajov sa dá priamo vyčistiť ε:
ε = 0.6346/(0.5 cm) (0.008739 m)
145.23 m-1∙ cm-1
Cvičenie 2
Nasledujúce absorbancie merané pri rôznych koncentráciách kovového komplexu pri vlnovej dĺžke 460 nm a s 1 cm dlhou bunkou: dĺžka:
A: 0.03010 0.1033 0.1584 0.3961 0.8093
C: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Vypočítajte molárnu absorpciu komplexu.
Je tu celkom päť bodov. Na výpočet ε je potrebné ich grafovať umiestnením hodnôt A na osi y. Akonáhle sa to stane, určí sa línia minimálnych štvorcov a s jeho rovnicou sa dá určiť ε.
V tomto prípade bodové grafy a nakreslili čiaru s koeficientom určenia r2 z 0.9905, sklon sa rovná 7 ∙ 10-4, to znamená εb = 7 ∙ 10-4.
Preto s b = 1 cm, ε bude 1428,57 m-1.cm-1 (1/7 ∙ 10-4).
Odkazy
- Koeficient. Získaný z.Wikipedia.orgán
- Vedecká štruktúra. Molárna absorpcia. Zotavené zo ScienceStruck.com
- Kolorimetrická analýza (právo piva alebo spektrofotometrická analýza). Chémia obnovená.UCLA.Edu

